题目内容
14.向130mL某浓度的硫酸溶液中加入一定量的铜片,在微热条件下反应,待铜片完全溶解,冷却后将溶液稀释至500mL,再加入过量铁粉,使之充分反应,生成的气体在标况下的体积为16.8L;过滤得到残留固体,经干燥、称量,比原铁粉质量减轻了35.6g.(1)与浓硫酸反应的铜片的质量为51.2 g
(2)原浓硫酸的物质的量浓度为18.1mol/L.
分析 根据反应方程式,判断反应的类型,根据气体的体积和固体质量的变化计算参加反应的铜和锌以及硫酸的物质的量,注意利用质量守恒定律.
解答 解:(1)设加入Cu片的量为xmol,n(H2)=$\frac{16.8L}{22.4L/mol}$=0.75mol
Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,
xmol 2xmol xmol
CuSO4+Fe═FeSO4+Cu
xmol xmol xmol
Fe+H2SO4═FeSO4+H2↑
0.75mol 0.75mol 0.75mol
由Fe溶解,产生Cu质量减轻35.6g可得:56g/mol×(xmol+0.75mol)-64g/mol×xmol=35.6g
∴x=0.8
∴加入Cu的质量为m(Cu)=64x=64×0.8=51.2g
答:与浓硫酸反应的铜片的质量为51.2g;
(2)原 H2SO4的物质的量浓度 c(H2SO4)=$\frac{2×0.8mol+0.75mol}{0.13L}$=18.1mol/L
答:原浓硫酸的物质的量浓度为18.1mol/L.
点评 本题考查化学方程式的计算,题目难度中等,注意有关反应方程式的书写,以及题中数据的处理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.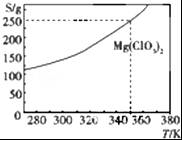 Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
 Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )| A. | 温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大 | |
| B. | 温度越高,Mg(ClO3)2饱和溶液的质量分数越大 | |
| C. | 350 K时,Mg(ClO3)2饱和溶液的质量分数为$\frac{250g}{350g}$×100% | |
| D. | 350K时,Mg(ClO3)2饱和溶液的物质的量浓度为$\frac{250g}{191g/mol×1L}$ |
19.下列事实中,能用勒夏特列原理解释的是( )
| A. | 由H2、I2、HI三种气体组成的平衡体系加压后颜色变深 | |
| B. | 对2SO2+O2?2SO3△H<0的反应,使用催化剂可加快反应的速率 | |
| C. | 实验室可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,500℃左右比室温更有利于合成NH3 |
6.下列有关实验装置进行的相应实验,设计正确且能达到实验目的是( )
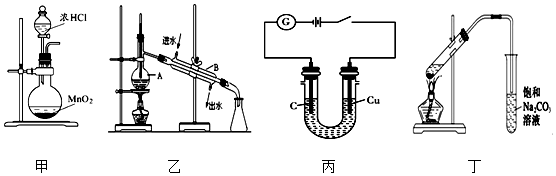

| A. | 利用装置甲制取氯气 | |
| B. | 利用装置乙分离乙酸(沸点:118℃)与乙酸乙酯(沸点:77.1℃) | |
| C. | 利用装置丙可电解食盐水制氯气和氢气 | |
| D. | 利用装置丁制取乙酸乙酯 |
3.从滴定管中滴下1滴溶液的体积接近( )
| A. | 0.5 mL | B. | 0.1 mL | C. | 0.05 mL | D. | 0.01 mL |
 实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题: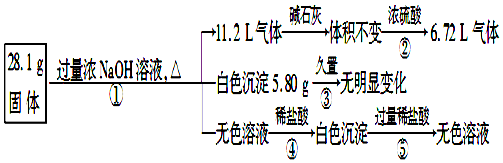
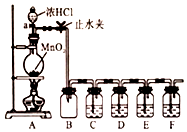 某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:
某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置: FeO(s) + CO(g) ΔH>0。反应过程中CO2气体和CO气体的浓度与时间的关系如下图所示:
FeO(s) + CO(g) ΔH>0。反应过程中CO2气体和CO气体的浓度与时间的关系如下图所示: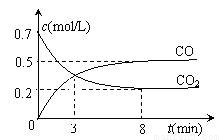
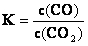
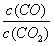 增大
增大