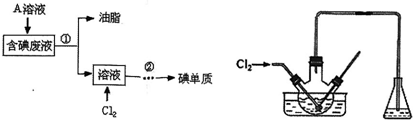
题目内容
4.MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示: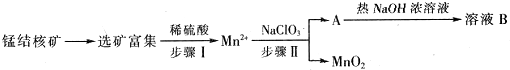
部分难溶的电解质溶度积常数(Ksp)如下表:
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1mol•L-1的NaClO3溶液200ml,该反应离子方程式为5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+.
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是氯酸钠.
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是MnO2+H2O+e-═MnOOH+OH-.如果维持电流强度为5A,电池工作五分钟,理论消耗锌0.5g.(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH、Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O.向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固
体为MnO2.
(5)用废电池的锌皮制作ZnSO4•7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为2.7时,铁刚好沉淀完全(离子浓度小于1×10-5mol•L-1时,即可认为该离子沉淀完全).继续加碱调节pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2,其后果和原因是Zn(OH)2、Fe(OH)2的Ksp相近,Zn2+和Fe2+分离不开.
分析 工业上从锰结核中制取纯净的MnO2工艺流程中,先选矿富集,锰结核为锰的氧化物与其它金属氧化物的混合物,加入稀硫酸和试剂甲发生反应生成Mn2+,说明发生了氧化还原反应生成锰离子,则甲为还原剂,在溶液中加入NaClO3反应生成MnO2、水和气体A等,A和热氢氧化钠溶液反应生成溶液B,溶液B中的产物之一(Q)可循环用于上述生产证明Q为NaClO3,则A为Cl2,B为氯化钠、氯酸钠的溶液,二氧化锰不溶于水,得到MnO2.
(1)0.1mol/L的NaClO3溶液200ml的物质的量是0.02mol,当消耗0.05molMn2+时,转移电子的物质的量是0.05mol×(4-2)=0.1mol,根据电子得失守恒可知0.02mol氯酸钠得到0.1mol电子,因此氯元素的化合价变化5价,即从+5价降低到0价,因此还原产物是氯气;
(2)氯气与热的氢氧化钠溶液反应生成氯酸钠、氯化钠和水;
(3)根据原电池工作原理判断正极发生还原反应,然后根据总反应写出正极的电极反应式;根据Q=It,计算出电子转移的数目,再结合电子守恒计算消耗的Zn的质量;
(4)根据反应物有稀草酸,产物有二氧化碳,则说明碳元素化合价升高发生氧化还原反应,所以锰化合价降低生成二价的MnSO4,据此书写;结合实验室利用MnO2和浓盐酸反应制氯气来检验黑色固体是否是二氧化锰;
(5)根据Fe(OH)3溶度积常数计算Fe3+离子浓度等于1×10-5mol•L-1时,溶液中OH-浓度,再计算溶液的pH;同样根据根据Zn(OH)2溶度积常数计算Zn2+浓度为0.1mol•L-1时,溶液中OH-浓度,再计算溶液的pH;如果不将Fe2+氧化成Fe3+,则可结合溶度积常数判断当Zn2+沉淀时,Fe2+是否沉淀,对产物的纯度有无影响.
解答 解:工业上从锰结核中制取纯净的MnO2工艺流程中,先选矿富集,锰结核为锰的氧化物与其它金属氧化物的混合物,加入稀硫酸和试剂甲发生反应生成Mn2+,说明发生了氧化还原反应生成锰离子,则甲为还原剂,在溶液中加入NaClO3反应生成MnO2、水和气体A等,A和热氢氧化钠溶液反应生成溶液B,溶液B中的产物之一(Q)可循环用于上述生产证明Q为NaClO3,则A为Cl2,B为氯化钠、氯酸钠的溶液,二氧化锰不溶于水,得到MnO2.
(1)0.1mol/L的NaClO3溶液200ml的物质的量是0.02mol,当生成0.05molMnO2时,转移电子的物质的量是0.05mol×(4-2)=0.1mol,根据电子得失守恒可知0.02mol氯酸钠得到0.1mol电子,因此氯元素的化合价变化5价,即从+5价降低到0价,因此还原产物是氯气,所以该反应离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑,故答案为:2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑;
(2)氯气与热的氢氧化钠溶液反应生成氯酸钠、氯化钠和水,因此可以循环的物质B是氯酸钠,
故答案为:氯酸钠;
(3)原电池中负极失去电子,正极得到电子,因此碱性锌锰电池放电时,正极是二氧化锰得到电子,则电极反应式为:MnO2+H2O+e-=MnO(OH)+OH-;5分钟转移电子的电量Q=It=5A×300s=1500C,转移电子的物质的量为$\frac{Q}{F}$=$\frac{1500C}{96500C/mol}$≈0.0155mol,则消耗的Zn的质量为$\frac{0.0155mol}{2}$×65g/mol=0.5g;故答案为:MnO2+H2O+e-═MnOOH+OH-;0.5g;
(4)因为反应物有稀草酸,产物有二氧化碳,则说明碳元素化合价升高发生氧化还原反应,所以锰化合价降低生成二价的MnSO4,方程式为2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;根据实验室制氯气的反应原理,取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2;故答案为:2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2;
(5)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol•L-1,因Ksp=10-39,
则c(OH-)=$\root{3}{\frac{{10}^{-39}}{1×1{0}^{-5}}}$mol/L≈0.5×10-11mol/L,此时pH=2.7,
如锌开始沉淀,则c(OH-)=$\sqrt{\frac{{10}^{-17}}{0.1}}$mol/L=10-8mol/L,此时pH=6,
由表中数据可知Zn(OH)2、Fe(OH)2的Ksp相近,如不加H2O2,则Zn2+和Fe2+分离不开,
故答案为:Fe3+;2.7;6;Zn(OH)2、Fe(OH)2的Ksp相近,Zn2+和Fe2+分离不开.
点评 本题考查内容较多,设计氧化还原反应的原理与应用、离子方程式的书写、溶度积常数及计算、制备实验方案的设计等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度中等.

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案| A. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| B. | 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 | |
| C. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| D. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| A. | 乙酸甲酯 | B. | 对苯二酚 | C. | 2-甲基丙烷 | D. | 对苯二甲酸 |
 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )| A. | 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.067mol/(L•min) | |
| B. | 根据如图该反应的平衡常数表达式为k=c2(A)•c(B) | |
| C. | 若在第5分钟时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 | |
| D. | 若在第7分钟时增加D的物质的量,A的物质的量变化情况符合a曲线 |
| a | ||
| c |
| A. | b离子发生水解使溶液呈酸性,c离子发生水解使溶液呈碱性 | |
| B. | 原子半径由小到大的顺序为:d<c<b | |
| C. | a的气态氢化物是造成温室效应的气体之一 | |
| D. | c在氧气中燃烧生成的产物有两种 |