题目内容
3.(NH4)2SO4是常见的化肥和化工原料,受热易分解.某兴趣小组拟探究其分解产物.[查阅资料](NH4)2SO4在 260℃和 400℃时分解产物不同.
[实验探究]该小组拟选用如图所示装置进行实验(夹持和加热装置略)
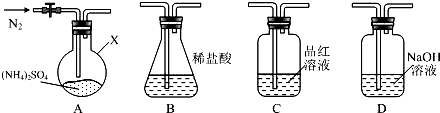
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL).通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2.品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00mL.经检验滴定后的溶液中无SO42-.
(1)仪器X的名称是圆底烧瓶.
(2)装置B内溶液吸收气体的物质的量是0.03mol
实验2:连接装置A-D-B,检查气密性,按如图所示重新加入试剂.通入N2排尽空气后,于 400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2.观察到装置A、D之间的导气管内有少量白色固体.经检验,该白色固体和装置D内溶液中有SO32-,无SO42-.进一步研究发现,气体产物中无氮氧化物.
(3)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是取少许D溶液于试管中,加入足量BaCl2溶液,有白色沉淀生成,再加入盐酸,白色沉淀完全溶解,生成刺激性气味的气体,说明D内溶液中有SO32-,无SO42-.
(4)装置B内溶液吸收的气体是NH3.
(5)(NH4)2SO4在 400℃分解的化学方程式是3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+N2↑+3SO2↑+6H2O↑.
分析 实验1:(1)根据装置图可知,仪器X为圆底烧瓶;
(2)根据消耗氢氧化钠计算B装置中剩余的HCl,参加反应的HCl吸收分解生成的NH3,发生反应:NH3+HCl=
NH4Cl,进而计算吸收NH3的物质的量,
实验2:(3)取D溶液于试管中,加入足量BaCl2溶液,再加入盐酸,白色沉淀完全溶解且生成刺激性气味的气体,说明D内溶液中有SO32-,无SO42-;
(4)装置D内溶液中有SO32-,说明分解生成SO2,装置A、D之间的导气管内有少量白色固体,白色固体应是二氧化硫、氨气与水形成的盐,装置B内溶液吸收的气体是氨气;
(5)由题干中分析可知,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,配平书写方程式.
解答 解:(1)由仪器X的结构可知,X为圆底烧瓶,故答案为:圆底烧瓶;
(2)滴定剩余盐酸,终点时消耗NaOH为0.025L×0.2mol/L=0.005mol,故剩余HCl为0.005mol,则参加反应的HCl为0.07L×0.5mol/L-0.005mol=0.03mol,参加反应的HCl吸收分解生成的NH3,发生反应:NH3+HCl=NH4Cl,故吸收NH3的物质的量为0.03mol,
故答案为:0.03;
(3)检查装置D内溶液中有SO32-,无SO42-的实验操作和现象是:取少许D溶液于试管中,加入足量BaCl2溶液,有白色沉淀生成,再加入盐酸,白色沉淀完全溶解,生成刺激性气味的气体,说明D内溶液中有SO32-,无SO42-,
故答案为:取少许D溶液于试管中,加入足量BaCl2溶液,有白色沉淀生成,再加入盐酸,白色沉淀完全溶解,生成刺激性气味的气体,说明D内溶液中有SO32-,无SO42-;
(4)装置D内溶液中有SO32-,说明分解生成SO2,装置A、D之间的导气管内有少量白色固体,白色固体应是二氧化硫、氨气与水形成的盐,装置B内溶液吸收的气体是氨气,
故答案为:NH3;
(5)由题干中分析可知,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,分解反应方程式为:3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+N2↑+3SO2↑+6H2O↑,
故答案为:3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+N2↑+3SO2↑+6H2O↑.
点评 本题考查化学实验,涉及化学仪器、滴定操作、实验方案设计、化学计算、物质推断、化学方程式书写等,是对学生综合能力的考查,较好的考查学生分析推理能力、知识迁移运用能力难度中等.

| A. | 气态氢化物的稳定性强弱:HF>HCl>HBr>HI | |
| B. | 原子半径大小:Mg>S>O | |
| C. | 碱性强弱:NaOH<Mg(OH)2 | |
| D. | 金属性强弱:K>Na |
| A. | Na+、K+、AlO2-、Cl- | B. | Ba2+、Na+、CO32-、NO3- | ||
| C. | Na+、Ag+、SO42-、Cl- | D. | Al3+、Fe3+、NO3-、SO42- |
| A. | 水玻璃 | B. | 漂白粉 | C. | 冰水 | D. | 氯水 |
| A. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 | |
| B. | 等质量的甲烷、乙烯、1,3-丁二烯(C4H6)分别在空气中充分燃烧,所耗用氧气的量依次增大 | |
| C. |  的单体是Cl-CH=CH2 的单体是Cl-CH=CH2 | |
| D. | 用新制氢氧化铜悬浊液不能鉴别乙醇溶液和葡萄糖溶液 |
| A. | 常温下,甲基橙呈红色的溶液中:Na+、NH4+、SO42-、CH3COO- | |
| B. | 滴入酚酞试液显红色的溶液:Na+、Ba2+、NO3-、Cl- | |
| C. | 由水电离出的c(H+)=1×10-13mol/L的溶液:NH4+、K+、CO32-、Cl- | |
| D. | 含有大量HCO3-的溶液:K+、Al3+、Cl-、Na+ |

 .
. 、
、 .
.