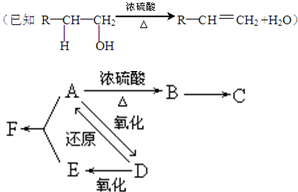
题目内容
A、B、C、D都是短周期元素,原子半径D>C>A>B.已知:A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍.试回答:
(1)这四种元素分别是:A ,B ,C ,D ;(填名称)
(2)这四种元素单质的熔点由高到低的顺序是 ;
(3)C的单质是 晶体,B的单质和C的单质在常温下反应的生成物属于 晶体.
(1)这四种元素分别是:A
(2)这四种元素单质的熔点由高到低的顺序是
(3)C的单质是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为: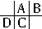 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C质子数等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D的4倍,则D最外层电子数只能为1,故D为钠,C为硅,A为碳,据此解答.
,C的原子核内的质子数等于A、B原子核内的质子数之和,C质子数等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D的4倍,则D最外层电子数只能为1,故D为钠,C为硅,A为碳,据此解答.
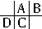 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C质子数等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D的4倍,则D最外层电子数只能为1,故D为钠,C为硅,A为碳,据此解答.
,C的原子核内的质子数等于A、B原子核内的质子数之和,C质子数等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D的4倍,则D最外层电子数只能为1,故D为钠,C为硅,A为碳,据此解答.解答:
解:根据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为: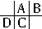 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C质子数等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D的4倍,则D最外层电子数只能为1,故D为钠,C为硅,A为碳,
,C的原子核内的质子数等于A、B原子核内的质子数之和,C质子数等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D的4倍,则D最外层电子数只能为1,故D为钠,C为硅,A为碳,
(1)由上述分析可知,A为碳,B为氧,C为硅,D为钠,
故答案为:碳;氧;硅;钠;
(2)这四种元素单质中,碳、硅为原子晶体,且碳原子半径小于硅,钠为金属晶体,而氧气为分子晶体,所以它们的熔点由高到低的顺序是 C>Si>Na>O2,
故答案为:C>Si>Na>O2;
(3)C的单质是硅,是原子原子晶体,B的单质是氧气,和硅反应的生成二氧化硅,属于原子晶体,
故答案为:原子;原子;
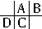 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C质子数等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D的4倍,则D最外层电子数只能为1,故D为钠,C为硅,A为碳,
,C的原子核内的质子数等于A、B原子核内的质子数之和,C质子数等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D的4倍,则D最外层电子数只能为1,故D为钠,C为硅,A为碳,(1)由上述分析可知,A为碳,B为氧,C为硅,D为钠,
故答案为:碳;氧;硅;钠;
(2)这四种元素单质中,碳、硅为原子晶体,且碳原子半径小于硅,钠为金属晶体,而氧气为分子晶体,所以它们的熔点由高到低的顺序是 C>Si>Na>O2,
故答案为:C>Si>Na>O2;
(3)C的单质是硅,是原子原子晶体,B的单质是氧气,和硅反应的生成二氧化硅,属于原子晶体,
故答案为:原子;原子;
点评:本题主要考查了晶体的性质及晶体的类型,难度不大,解题时要熟记元素在周期表的位置,以便快速确定元素的种类.

练习册系列答案
相关题目
下列说法正确的是( )
| A、44 g CO2中含有2 mol C |
| B、O2的摩尔质量是32 g/mol |
| C、18 g H2O在标准状况下的体积是22.4 L |
| D、将58.5 g NaCl溶于1 L水中,所得溶液中NaCl的物质的量浓度为1 mol/L |
将a g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08mol,放出标准状况下气体0.224L.则下列判断中正确的是( )
| A、原混合物中n(Fe):n(Fe2O3)=2:1 |
| B、向溶液中滴入KSCN溶液,显红色 |
| C、无法计算原混合物的质量a |
| D、此时溶液中Fe2+和Fe3+的物质的量之比为3:1 |
1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子.现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则下列说法正确的是( )
| A、A元素在周期表中的位置是第六周期第ⅠA族 |
| B、单质A性质稳定 |
| C、A元素的最高价氧化物的水化物是一种强碱 |
| D、A有多种氧化物,但均不与水反应 |
一定条件下磷与干燥氯气反应,若12.4g磷消耗掉15.68L氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于( )
| A、1:2 | B、2:3 |
| C、3:1 | D、5:3 |
下列正确的叙述有( )
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质.
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质.
| A、①②③⑤ | B、②③⑤ |
| C、②③ | D、全部 |
乙酸和甲酸甲酯(HCOOCH3)的关系是( )
| A、同系物 | B、同位素 |
| C、同分异构体 | D、同素异形体 |