题目内容
将a g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08mol,放出标准状况下气体0.224L.则下列判断中正确的是( )
| A、原混合物中n(Fe):n(Fe2O3)=2:1 |
| B、向溶液中滴入KSCN溶液,显红色 |
| C、无法计算原混合物的质量a |
| D、此时溶液中Fe2+和Fe3+的物质的量之比为3:1 |
考点:有关混合物反应的计算
专题:
分析:根据化学方程式Fe+2HCl=FeCl2+H2↑中H2的量来计算出Fe和HCl的量,再由Fe2O3+6HCl=2FeCl3+3H2O 算出Fe2O3和FeCl3的量,由题目数据计算这个反应中消耗的HCl的量,得出n(FeCl3)、n(Fe2O3),最后由Fe+2Fe3+=3Fe2+中,根据铁离子的量算出消耗Fe的量,然后计算出反应中消耗铁的总物质的量.
解答:
解:因为Fe3+和H+的氧化性强弱顺序为Fe3+>H+,所以当产生氢气时,Fe3+已经全部被还原为Fe2+,故向溶液中滴入KSCN溶液,溶液不变红,故B、D错误;
标况下0.224L氢气的物质的量为:
=0.01mol,根据化学方程式Fe+2HCl=FeCl2+H2↑可知,n(Fe)=n(H2)=0.01mol,n(HCl)=2n(H2)=0.02mol,
由Fe2O3+6HCl=2FeCl3+3H2O算出Fe2O3和FeCl3的量,由题目可知,该反应中消耗的HCl的量为:0.08-0.02=0.06mol,则:n(FeCl3)=
n(HCl)=0.02mol,n(Fe2O3)=
n(Fe2O3)=0.01mol,根据反应Fe+2Fe3+=3Fe2+可知,铁离子消耗的铁的物质的量为:n(Fe)=
(Fe3+)=0.01mol,原混合物中铁的总物质的量为:0.01mol+0.01mol=0.02mol,则:n(Fe):n(Fe2O3)=0.02mol:0.01mol=2:1,故A正确、C错误;
故选A.
标况下0.224L氢气的物质的量为:
| 0.224L |
| 22.4L/mol |
由Fe2O3+6HCl=2FeCl3+3H2O算出Fe2O3和FeCl3的量,由题目可知,该反应中消耗的HCl的量为:0.08-0.02=0.06mol,则:n(FeCl3)=
| 2 |
| 6 |
| 1 |
| 2 |
| 1 |
| 2 |
故选A.
点评:本题考查有关混合物反应的计算,题目难度中等,明确氧化性强弱及反应先后顺序为解答关键,注意掌握有关混合物反应的化学计算方法与技巧,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、同一物质的固、液、气三种状态的熵相同 |
| B、0.1 mol铁在0.1 mol Cl2中充分燃烧,有0.3NA个电子转移 |
| C、等物质的量的钠分别在足量的氧气和氯气中燃烧,转移电子数相等 |
| D、1.5 mol NO2与足量H2O反应,转移的电子数为2NA |
下列化合物中,属于盐的是( )
| A、H2O |
| B、Na2CO3 |
| C、HNO3 |
| D、KOH |
有两种金属粉末均匀混合组成的混合物2.4g与足量稀盐酸充分反应,生成标准状况下的H22.24L,则该混合物的可能组成为( )
| A、Mg和Al |
| B、Mg和Fe |
| C、Fe和Zn |
| D、Al和Cu |
下列水解反应的化学方程式错误的是( )
| A、Fe3++3H2O═Fe(OH)3+3H+ |
| B、HSO3-+H2O?H2SO3+OH- |
| C、CH3COO-+H2O?CH3COOH+OH- |
| D、A13++3HCO3-═Al(OH)3↓+3CO2↑ |
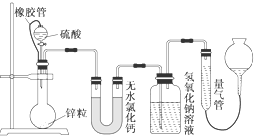 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.