题目内容
一定条件下磷与干燥氯气反应,若12.4g磷消耗掉15.68L氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于( )
| A、1:2 | B、2:3 |
| C、3:1 | D、5:3 |
考点:化学方程式的有关计算
专题:
分析:根据n=
计算磷的物质的量,根据n=
计算氯气的物质的量,设PCl3与PCl5的物质的量分别为xmol、ymol,根据P元素、Cl元素守恒列方程计算解答.
| m |
| M |
| V |
| Vm |
解答:
解:12.4g磷的物质的量为
=0.4mol,
15.68L氯气(标准状况)的物质的量为
=0.7mol,
设PCl3与PCl5的物质的量分别为xmol、ymol,根据P元素、Cl元素守恒,则:
解得x=0.3 y=0.1,
故产物中PCl3与PCl5的物质的量之比为0.3mol:0.1mol=3:1,
故选C.
| 12.4g |
| 31g/mol |
15.68L氯气(标准状况)的物质的量为
| 15.68L |
| 22.4L/mol |
设PCl3与PCl5的物质的量分别为xmol、ymol,根据P元素、Cl元素守恒,则:
|
解得x=0.3 y=0.1,
故产物中PCl3与PCl5的物质的量之比为0.3mol:0.1mol=3:1,
故选C.
点评:本题考查化学有关计算,难度中等,本题利用原子守恒计算产物中PCl3和PCl5的物质的量,也可以利用十字交叉法进行计算解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式书写正确的是( )
| A、氯气跟水反应:Cl2+H2O=2H++Cl-+ClO- |
| B、硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| C、碳酸钠溶液中加入少量稀盐酸:CO32-+H+=HCO3- |
| D、铜与稀盐酸反应:Cu+2H+=Cu2++H2↑ |
有两种金属粉末均匀混合组成的混合物2.4g与足量稀盐酸充分反应,生成标准状况下的H22.24L,则该混合物的可能组成为( )
| A、Mg和Al |
| B、Mg和Fe |
| C、Fe和Zn |
| D、Al和Cu |
下列各组物质都属于强电解质的是( )
| A、KCl、HCl、CO2 |
| B、Ba(OH)2、CH3COOH、NH3?H2O |
| C、NaHCO3、BaSO4、HNO3 |
| D、H2SO4、Fe(OH)3、H2O |
下列表示物质结构的化学用语正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、NaCl的电子式: |
C、镁离子的结构示意图: |
D、CH4的比例模型: |
在一定条件下,下列物质不能发生消去反应的是( )
| A、C2H5OH |
| B、(CH3)2CHCl |
| C、(CH3)3CCl |
| D、(CH3)3CCH2Cl |
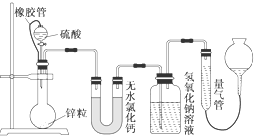 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.