题目内容
5.下列说法正确的是( )| A. | 一定条件下,增加反应物的量,必定加快反应速率 | |
| B. | 升高温度正反应速率增大,逆反应速率也增大 | |
| C. | 可逆反应的特征是正反应速率总是和逆反应速率相等 | |
| D. | 增大压强一定会加快反应速率 |
分析 A.一定条件下,如果反应物是固体或纯液体,固体或纯液体反应物量的多少不影响反应速率;
B.升高温度,正逆反应速率都增大;
C.逆反应的特征是正反应和逆反应都在同时发生,同时进行;
D.如不是气体参加的反应,则增大压强,速率不改变.
解答 解:A.一定条件下,如果反应物是固体或纯液体,固体或纯液体反应物量的多少不影响反应速率,所以增大反应物的量不一定加快反应速率,故A错误;
B.升高温度,增大活化分子百分数,所以正逆反应速率都增大,故B正确;
C.逆反应的特征是正反应和逆反应都在同时发生,同时进行,化学平衡状态的特征之一是正反应速率和逆反应速率相等的状态,故C错误;
D.如不是气体参加的反应,则增大压强,浓度不变,速率不改变,故D错误;
故选B.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度、温度、催化剂等因素对化学反应速率影响原理是解本题关键,注意这些影响因素适用范围,易错选项是D.

练习册系列答案
相关题目
15.无色溶液中可以大量共存的是( )
| A. | Fe3+、Cl-、Na+、SO42- | B. | MnO4-、K+、Cl-、Na+ | ||
| C. | NH4+、SO42-、OH-、Na+ | D. | CO32-、HCO3-、K+、Na+ |
13.化学与生活、生产密切相关,下列有关说法正确的是( )
| A. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| B. | 二氧化硫可以漂白纸浆 | |
| C. | 硅酸可以用于刻蚀玻璃 | |
| D. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
20.某太阳能电池的工作原理如图所示.下列说法正确的是( )
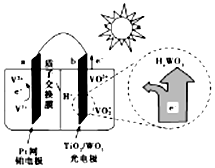

| A. | 光照时,b极的电极反应式为VO2+-e-+H2O═VO2++2H+ | |
| B. | 光照时,毎转移2mol电子,有2mol H+由a极区经质子交换膜向b极区迁移 | |
| C. | 夜间,a极的电极反应式为V3++e-═V2+ | |
| D. | 硅太阳能电池供电原理与该电池相同 |
10.下列化学方程式中,属于水解反应的是( )
| A. | CH3COOH+H2O?CH3COO-+H3O+ | B. | HS-+H2O?S2-+H3O+ | ||
| C. | CO2+H2O?HCO3-+H+ | D. | CO32-+H2O?HCO3-+OH- |
17.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入CO2至过量
②向Fe(OH)3胶体中逐滴加入稀盐酸至过量
③向NaAlO2 溶液中通入CO2至过量
④向 AlCl3溶液中加入 Ba(OH)2溶液至过量
⑤向CaCl2溶液中通入 CO2 至过量.
①向饱和碳酸钠溶液中通入CO2至过量
②向Fe(OH)3胶体中逐滴加入稀盐酸至过量
③向NaAlO2 溶液中通入CO2至过量
④向 AlCl3溶液中加入 Ba(OH)2溶液至过量
⑤向CaCl2溶液中通入 CO2 至过量.
| A. | ①③⑤ | B. | ①② | C. | ①③ | D. | ②③⑤ |
14.为了检验SO2的性质,下列实验现象、解释与结论均正确的是( )
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 将SO2气体通入KMnO4(H+)溶液中 | 溶液褪色 | SO2有漂白性 |
| B | 将SO2气体通入H2S溶液中 | 溶液变浑浊 | SO2有氧化性 |
| C | 将SO2气体通入紫色石蕊溶液中 | 溶液先变红色后褪色 | SO2是酸性氧化物 |
| D | 将SO2气体通入Ca(ClO)2溶液中 | 溶液变浑浊 | 亚硫酸的酸性比次氯酸的酸性强 |
| A. | A | B. | B | C. | C | D. | D |
2.配制200mL 0.100mol•L-1盐酸溶液时,下列实验操作使所配的溶液浓度偏大的是( )
| A. | 用量筒量取所需的浓盐酸时仰视读数 | |
| B. | 用量筒量取的浓盐酸时,量筒里有少许蒸馏水 | |
| C. | 定容时,仰视标线 | |
| D. | 定容后倒转容量瓶数次摇匀,发现液面最低点低于标线,再补加几滴蒸馏水至标线 |