题目内容
下列离子方程式正确的是( )
| A、铁溶于足量的稀硝酸,溶液变黄:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
| B、NaHSO4溶液与NaOH溶液混合:OH-+H+=H2O |
| C、NH4HCO3溶液与足量KOH浓溶液共热:NH4++OH-?NH3↑+H2O |
| D、Fe2O3溶于足量的氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应生成硝酸铁、NO和水;
B.反应生成硫酸钠和水;
C.漏写碳酸氢根离子与碱的反应;
D.发生氧化还原反应,生成碘化亚铁、碘、水.
B.反应生成硫酸钠和水;
C.漏写碳酸氢根离子与碱的反应;
D.发生氧化还原反应,生成碘化亚铁、碘、水.
解答:
解:A.铁溶于足量的稀硝酸,溶液变黄,证明反应生成的是Fe3+,而不是Fe2+,故离子反应为Fe+4H++NO3-=Fe3++NO↑+2H2O,故A错误;
B.NaHSO4溶液与NaOH溶液混合的离子反应为OH-+H+=H2O,故B正确;
C.NH4HCO3溶液与足量KOH浓溶液共热的离子反应为HCO3-+NH4++2OH-
NH3↑+2H2O+CO32-,故C错误;
D.Fe2O3溶于足量的氢碘酸溶液中,由于2Fe3++有强氧化性,I-有强还原性,会发生氧化还原反应,故离子反应为2I-+Fe2O3+6H+=2Fe2++I2+3H2O,故D错误;
故选B.
B.NaHSO4溶液与NaOH溶液混合的离子反应为OH-+H+=H2O,故B正确;
C.NH4HCO3溶液与足量KOH浓溶液共热的离子反应为HCO3-+NH4++2OH-
| ||
D.Fe2O3溶于足量的氢碘酸溶液中,由于2Fe3++有强氧化性,I-有强还原性,会发生氧化还原反应,故离子反应为2I-+Fe2O3+6H+=2Fe2++I2+3H2O,故D错误;
故选B.
点评:本题考查离子反应方程式的书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及与量有关的离子反应书写,综合性较强,较好的训练学生思维的严密性,有利于分析能力的培养,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
反应SO2(g)+NO2(g)?NO(g)+SO3(g)在恒温恒容下建立平衡后,通入一定量的O2,下列说法正确的是( )
| A、平衡左移,达到平衡时容器内压强增大 |
| B、平衡右移,达到平衡时容器内压强不变 |
| C、平衡不移动,达到平衡时容器内压强增大 |
| D、平衡右移,SO2的转化率提高 |
下列有关实验的说法正确的是( )
| A、将FeCl3溶液加热至沸腾,溶液由黄色变为红褐色 |
B、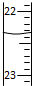 滴定达终点时,如图滴定管的正确读数为23.65 mL |
| C、向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 |
| D、测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
下列离子方程式正确的是( )
| A、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+ |
| D、等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
将0.2mol/L HCN溶液和0.1mol/L NaOH溶液等体积混合后溶液呈碱性,下列关系式中不正确的是( )
| A、c(HCN)>c(CN-) |
| B、c(Na+)>c(CN-) |
| C、c(HCN)-c(CN-)=c(OH-) |
| D、c(HCN)+c(CN-)=0.1mol/L |
 2016年奥运会将在里约热内卢举行,如图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成.A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3:4,电子数之比为3:2.
2016年奥运会将在里约热内卢举行,如图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成.A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3:4,电子数之比为3:2.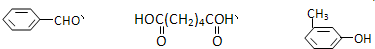
 互为同分异构体的是
互为同分异构体的是 在如图所示的电解装置中:
在如图所示的电解装置中: 已知:A、B、C、D、E、G、L七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;L原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、G的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与G能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、G、L七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;L原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、G的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与G能形成原子数目比为1:3、熔点为190℃的化合物Q.