题目内容
下列有关物质的性质和该性质的应用均正确的是( )
| A、铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、常温下浓硫酸能与铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸 |
| D、二氧化氯具有还原性,可用于自来水的杀菌消毒 |
考点:金属的电化学腐蚀与防护,氯、溴、碘及其化合物的综合应用,浓硫酸的性质,硅和二氧化硅
专题:元素及其化合物
分析:A、铁活泼性强于铜,形成原电池时,铁做负极失电子被氧化.
B、二氧化硅可与HF酸反应.
C、常温下,铝和铁在浓硫酸、浓硝酸里会钝化.
D、用ClO2杀菌消毒是利用了强氧化性.
B、二氧化硅可与HF酸反应.
C、常温下,铝和铁在浓硫酸、浓硝酸里会钝化.
D、用ClO2杀菌消毒是利用了强氧化性.
解答:
解:A、铁活泼性强于铜,形成原电池时,铁做负极失电子被氧化,铜被保护,故不但起不到减缓海轮腐蚀的作用,还会加剧腐蚀,故A错误.
B、SiO2虽然是酸性氧化物,与一般的酸不反应,却能与HF反应,故B错误.
C、常温下,铝和铁在浓硫酸、浓硝酸里会钝化,故常温下可以用铝制贮藏贮运浓硫酸,故C正确.
D、用ClO2杀菌消毒是利用了其强氧化性,而不是还原性,故D错误.
故选C.
B、SiO2虽然是酸性氧化物,与一般的酸不反应,却能与HF反应,故B错误.
C、常温下,铝和铁在浓硫酸、浓硝酸里会钝化,故常温下可以用铝制贮藏贮运浓硫酸,故C正确.
D、用ClO2杀菌消毒是利用了其强氧化性,而不是还原性,故D错误.
故选C.
点评:本题考查了常见物质的性质及性质的有关应用,属于理解识记型题目,较简单.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
对铜-锌-稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是( )
| A、锌片溶解了32.5克 |
| B、锌片增重了32.5克 |
| C、铜片上放出了11.2L氢气 |
| D、铜片上放出了1mol氢气 |
在密闭容器中进行的可逆反应X2(g)+Y2(g)═2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.2mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Y2物质的浓度可能是( )
| A、0.35mol/L |
| B、0.2mol/L |
| C、0.4mol/L |
| D、0.3mol/L |
下列说法正确的是( )
| A、测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
| B、为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次混合溶液的pH |
| C、常温下若强酸、强碱等体积中和后pH=7,则中和之前pH酸+pH碱=14 |
| D、在pH=12的某溶液中,水电离出的c(OH-)=10-2mol/L |
2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国).下列关于Ds的说法不正确的是( )
| A、Ds原子在周期表中位于第7周期第ⅦB族 |
| B、Ds是过渡元素 |
| C、Ds原子的核外排布为[Rn]5f146d87S2 |
| D、Ds原子的核外有110个电子 |
下列化合物的沸点比较,前者低于后者的是( )
| A、乙醇与氯乙烷 |
| B、邻羟基苯甲酸与对羟基苯甲酸 |
| C、对羟基苯甲醛与邻羟基苯甲醛 |
| D、H2O与H2Te |
氨水中存在下列的电离平衡:NH3?H2O?NH4++OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
| A、NaOH固体 |
| B、NH4Cl固体 |
| C、H2SO4 |
| D、H2O |
下列过程中没有破坏化学键的是( )
| A、氯化氢溶于水 | B、氯化铵分解 |
| C、食盐熔化 | D、干冰升华 |
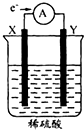 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )| A、外电路的电流方向为:X→导线→Y |
| B、若两电极都是金属,则它们的活动性顺序为X<Y |
| C、X极上发生的是还原反应,Y极上发生的是氧化反应 |
| D、溶液中的SO42-向X极移动 |