题目内容
14.氮的单质及其化合物性质多样,用途广泛.完成下列填空.
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间的CO浓度如表:
| 时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(2)工业合成氨的反应温度选择500℃左右的原因是催化剂在500℃左右具有最佳活性.
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是bc.
a.N2、H2、NH3的浓度之比为1:3:2
b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是c(Cl-)>(NH4+)>c(H+)>c(OH-);在通入NH3的过程中溶液的导电能力几乎不变(选填“变大”、“变小”、“几乎不变”).
分析 (1)根据平衡常数等于生成物浓度的系数次幂之积除以反应浓度系数次幂之积写平衡常数的表达式,根据温度对平衡移动的影响判断反应的平衡常数的变化;根据v=$\frac{△c}{△t}$,进行计算;一氧化氮的转化率变大,说明平衡正向移动;
(2)工业合成氨的反应是可逆的,选择500℃左右的较高温度能使反应逆向进行,不利于化学平衡的正向移动,使用该温度主要是考虑催化剂的催化效率以及反应速率等知识;
(3)原变化的量现不变,说明达平衡状态;
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3(溶液体积变化忽略不计),生成氯化铵,是强酸弱碱盐,离子浓度的大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);离子浓度几乎不变.
解答 解:(1)根据平衡常数等于生成物浓度的系数次幂之积除以反应浓度系数次幂之积,所以K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$,该反应为放热反应,温度时平衡逆向移动,所以平衡常数减小,v(CO)=$\frac{△c}{△t}$=$\frac{3.60×1{0}^{-3}-2.85×1{0}^{-3}}{2}$=3.75×10-4mol/l,v(N2)=$\frac{v(CO)}{2}$=1.875×10-4mol/(L•s);一氧化氮的转化率变大,说明平衡正向移动可以通过改变压强,使平衡正向移动,故答案为:$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;减小;1.875×10-4mol/(L•s);增大压强;
(2)工业合成氨的反应是可逆的,选择500℃左右的较高温度能使反应逆向进行,不利于化学平衡的正向移动,使用该温度主要是考虑催化剂的催化效率以及反应速率等知识,故答答案为:催化剂在500℃左右具有最佳活性;
(3)a.N2、H2、NH3的浓度之比为1:3:2,并不是不变,故错误;
b.容器内的压强保持不变,说明气体的物质的量不变,反应达平衡状态,故正确;
c.N2、H2、NH3的浓度不再发生变化,说明正逆反应速率相等,反应达平衡状态,故正确;
d.化学平衡状态是动态平衡,反应不可能停止,故错误;
故选:bc;
(4)二者恰好反应生成氯化铵,溶液呈酸性,即c(H+)>c(OH-),依据溶液呈电中性有:c(H+)+c(NH4+)=c(OH-)+c(Cl-),因为c(H+)>c(OH-),∴c(NH4+)<c(Cl-),故离子浓度大小关系为:c(Cl-)>(NH4+)>c(H+)>c(OH-),溶液中离子浓度几乎不变,所以导电能力几乎不变,故答案为:c(Cl-)>(NH4+)>c(H+)>c(OH-);几乎不变.
点评 本题考查了离子浓度大小比较,根据溶液中的溶质及溶液酸碱性判断离子浓度的大小,化学平衡状态可通过原来变量现不变说明达平衡状态,为易错点.

 名校课堂系列答案
名校课堂系列答案| A. | 球棍模型: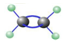 | B. | 分子中六个原子在同一平面上 | ||
| C. | 键角:109o28’ | D. | 碳碳双键中的一根键容易断裂 |
| A. | 苯酚沾在手上应立即用酒精洗涤 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| C. | 点燃甲烷、乙烯等可燃性气体前必须先检验其纯度 | |
| D. | 在苯酚溶液中滴入少量稀溴水出现白色沉淀 |
| A. | 标准状况下,22.4LHF中的原子数目为2NA | |
| B. | 在18 g18O2中含有NA个氧原子 | |
| C. | 常温常压下,17g的NH3含有的电子数为10NA | |
| D. | NA 个CO2分子中含有4mol极性键 |
| 选项 | 实验 | 现象 | 结论 |
| A | 漂白粉在空气中久置 | 漂白粉变为块状 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| B | 用坩埚钳夹住点燃的镁条伸入二氧化碳气体中 | 镁条剧烈燃烧 | 二氧化碳作还原剂 |
| C | 向1.0mol•L-1的NaHCO3溶液中滴加2滴甲基橙 | 溶液呈黄色 | NaHCO3溶液呈碱性 |
| D | 向浓度均为0.1mol•L-1的Al2(SO4)3、Fe2(SO4)3的溶液中逐滴加入氨水 | 先有红褐色沉淀生成,后有白色色沉淀生成 | Al(OH)3的溶度积比Fe(OH)3的大 |
| A. | A | B. | B | C. | C | D. | D |
| 离子组 | 加入试剂 | 离子方程式 | |
| A | Al3+、SO42- | 适量Ba(OH)2溶液 | Al3++3OH-═Al(OH)3↓ |
| B | Fe2+、I- | 足量新制氯水 | Cl2+2I-═2Cl-+I2 |
| C | Fe3+、NO3- | NaHSO3溶液 | 3SO32-+2NO3-+2H+═3SO42-+2NO↑+H2O |
| D | Ca2+、HCO3- | 氨水 | Ca2++2HCO3-+2NH3•H2O═CaCO3↓+CO32-+2NH4++2H2O |
| A. | A | B. | B | C. | C | D. | D |
| A. | 任何可逆反应都有一定的限度 | |
| B. | 反应条件改变,化学反应限度可能改变 | |
| C. | 化学反应达到平衡时,正、逆反应速率一定相等 | |
| D. | 化学反应达到平衡时,所有物质的微粒均不再变化 |
 .下列有关M的说法正确的是( )
.下列有关M的说法正确的是( )| A. | 1mol M与烧碱溶液反应时最多消耗2molNaOH | |
| B. | M不能使酸性KMnO4溶液褪色,但能发生取代反应 | |
| C. | M的分子式为C8H14O3 | |
| D. | M可通过加聚反应生成高分子化合物 |
 ;
;