题目内容
2.A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸.请根据以上信息回答下列问题:(1)B元素在元素周期表中的位置是第三周期IA族;
(2)画出C元素的原子结构示意图
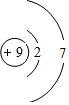 ;
;(3)与E的氢化物分子所含电子总数相等的分子是H2O或NH3或HF或CH4(举一例,填化学式,下同)、阳离子是Na+或Mg2+或NH4+或H3O+;
(4)A与D形成的化合物中含有化学键的类型是极性共价键.
分析 A、B、C、D、E都为短周期元素,A是相对原子质量最小的,则A为氢元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层排布,则B为Na元素,C为F元素;D在C的下一周期,可与B形成BD型离子化合物,则D为Cl元素;E和C为同一周期元素,其最高价氧化物的水化物为强酸,则E为N元素,据此解答.
解答 解:A、B、C、D、E都为短周期元素,A是相对原子质量最小的,则A为氢元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层排布,则B为Na元素,C为F元素;D在C的下一周期,可与B形成BD型离子化合物,则D为Cl元素;E和C为同一周期元素,其最高价氧化物的水化物为强酸,则E为N元素.
(1)B为Na元素,处于周期表中第三周期IA族,故答案为:三;IA;
(2)C为F元素,原子结构示意图为 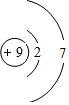 ,故答案为:
,故答案为: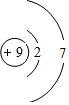 ;
;
(3)E的氢化物分子为NH3,与之所含电子总数相等的分子是H2O 或 NH3或 HF 或 CH4,离子是Na+或 Mg 2+或 NH4+或 H3O+,故答案为:H2O 或 NH3或 HF 或 CH4;Na+或 Mg 2+或 NH4+或 H3O+;
(4)A、D形成的化合物为HCl,含有极性共价键,故答案为:极性共价键.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意原子结构示意图,比较容易.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
2.化学与生活息息相关,下列说法正确的是( )
| A. | 食盐可作调味剂,也可以用作食品防腐剂 | |
| B. | 碳酸钾有一定的去污能力,在热水中去污能力会减弱 | |
| C. | 煤经过气化和液化等变化后,可以减少PM2.5引起的污染 | |
| D. | 根据纤维燃烧产生的气味,不能确定是否为蛋白质纤维 |
13.颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物.请回答下列问题:
①将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据计算PM2.5待测试样的pH=5.
②汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图3:
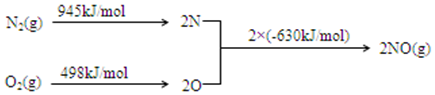
则:NO(g)?$\frac{1}{2}$N2(g)+$\frac{1}{2}$O2(g)△H=-91.5kJ•mol-1.
①将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-5 | 6×10-5 | 2×10-4 | 4×10-4 | 3×10-4 | 2×10-4 |
②汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图3:

则:NO(g)?$\frac{1}{2}$N2(g)+$\frac{1}{2}$O2(g)△H=-91.5kJ•mol-1.
10.下列有关叙述中正确的是( )
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 周期表中的主族中都既有非金属元素又有金属元素 | |
| D. | 原子的最外层电子数相同的元素,一定属于同一族 |
17.下列关于有机物的叙述正确的是( )
| A. | 乙烷与氯气光照反应可以制得较纯净的1,2-二氯乙烷 | |
| B. | 苯中的化学键都是非极性键 | |
| C. | 煤的干馏属于物理变化 | |
| D. | 涤纶、酚醛树脂和蛋白质都属于高分子化合物 |
7.下列图示与对应的叙述符合的是( )
| A. | 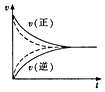 用实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化 | |
| B. | 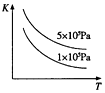 表示反应2SO2(g)+O2(g)?2SO3(g)△H<0的平衡常数K与温度和压强的关系 | |
| C. | 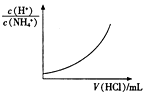 表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$随HCl溶液体积变化关系 | |
| D. | 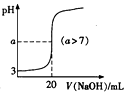 表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系 |
14.氮的单质及其化合物性质多样,用途广泛.
完成下列填空.
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间的CO浓度如表:
该反应平衡常数K的表达式为$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;温度升高,K值减小(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=1.875×10-4mol/(L•s);若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是增大压强.
(2)工业合成氨的反应温度选择500℃左右的原因是催化剂在500℃左右具有最佳活性.
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是bc.
a.N2、H2、NH3的浓度之比为1:3:2
b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是c(Cl-)>(NH4+)>c(H+)>c(OH-);在通入NH3的过程中溶液的导电能力几乎不变(选填“变大”、“变小”、“几乎不变”).
完成下列填空.
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间的CO浓度如表:
| 时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(2)工业合成氨的反应温度选择500℃左右的原因是催化剂在500℃左右具有最佳活性.
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是bc.
a.N2、H2、NH3的浓度之比为1:3:2
b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是c(Cl-)>(NH4+)>c(H+)>c(OH-);在通入NH3的过程中溶液的导电能力几乎不变(选填“变大”、“变小”、“几乎不变”).
11.下列元素中,属于主族元素的是( )
| A. | Cu | B. | Na | C. | Fe | D. | Zn |
12.某有机物Q的结构简式如图,下列有关Q的说法正确的是( )
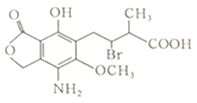

| A. | 分子式为C14H25O6NBr | |
| B. | 该分子中含有两个手性碳原子 | |
| C. | 不能使酸性高锰酸钾溶液褪色 | |
| D. | Q在一定条件下与氢氧化钠溶液反应,1molQ最多消耗3molNaOH |