题目内容
14.有A、B、C、D四块金属,若A、B用导线相连成原电池时,A为负极;若C、D相连构成原电池时,电流由D流向C;A、C相连浸入稀硫酸中时,C极上产生大量气泡;把D投入到B的硫酸盐溶液中,D的表面有B析出;则四种金属的活动性顺序为( )| A. | B>D>C>A | B. | C>A>B>D | C. | A>C>D>B | D. | A>B>C>D |
分析 A、B、C、D四块金属,若A、B用导线相连成原电池时,A为负极,则金属性A>B;若C、D相连构成原电池时,电流由D流向C,则C为负极,金属性C>D;A、C相连浸入稀硫酸中时,C极上产生大量气泡,则C为正极、A为负极,则金属性A>C;把D投入到B的硫酸盐溶液中,D的表面有B析出,则金属性D>B,据此可判断金属性强弱.
解答 解:A、B用导线相连成原电池时,A为负极,则金属性A>B;若C、D相连构成原电池时,电流由D流向C,则C为负极,金属性C>D;A、C相连浸入稀硫酸中时,C极上产生大量气泡,则C为正极、A为负极,则金属性A>C;把D投入到B的硫酸盐溶液中,D的表面有B析出,则金属性D>B,
根据分析可知,四种金属的活动性顺序为:A>C>D>B,
故选C.
点评 本题考查了原电池工作原理的应用,题目难度不大,明确原电池两极与金属活泼性的关系为解答关键,注意掌握原电池工作原理,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
4.反应m A+n B?p C中,m、n、p为各物质的计量数.现测得C每分钟增加a mol/L,B每分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为( )
| A. | 2:3:1 | B. | 1:3:2 | C. | 2:3:3 | D. | 3:2:1 |
5.下列物质中含有非极性键的共价化合物是( )
| A. | H2O2 | B. | CH4 | C. | Na2O2 | D. | I2 |
2.工业上可通过电解NO制备NH4NO3,其工作原理如图所示.下列说法不正确的是( )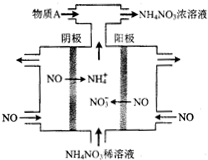

| A. | NO是常见的大气污染物之一,该装置可实现废气的治理与回收利用 | |
| B. | 阳极反应为:NO-3e-+2H2O═NO3-+4H+ | |
| C. | 阴极反应为:NO+5e-+6H+═NH4++H2O | |
| D. | 为使电解产物全部转化为NH4NO3,需向该电解池中补充水 |
19.利用如图装置可以验证NH3和HCl的有关性质.下列有关说法不正确的是( )

| A. | 关闭活塞c,打开活塞a、b,挤压胶头滴管,Ⅱ中产生喷泉 | |
| B. | 关闭活塞a,打开活塞b、c,用热毛巾敷热烧瓶I,I中产生喷泉 | |
| C. | 关闭活塞b,打开活塞a、c,用热毛巾敷热烧瓶II,I中会产生白雾 | |
| D. | 关闭活塞b,打开活塞a、c,用热毛巾敷热烧瓶II,一段时间后,打开活塞b,I、II中均产生喷泉 |
3.金属一般具有的性质是( )
| A. | 在反应中作氧化剂 | B. | 原子中电子的个数比较少 | ||
| C. | 熔、沸点都比较高 | D. | 能导电、导热,有延展性 |
 .
. .其中心原子的杂化类型为sp3.
.其中心原子的杂化类型为sp3. .
. A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验: