题目内容
13.中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性.在25℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+的浓度来测定溶液的pH.已知100℃时,水的离子积常数Kw=1×10-12.(1)已知水中存在如下平衡:H2O+H2O?H3O++OH-△H>0,现欲使平衡向左移动,且所得溶液呈酸性,选择的方法是A(填字母).
A.向水中加入NaHSO4B.向水中加入NaClC.加热水至100℃D.在水中加入KOH
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显淡黄色色,溶液显中性(填“酸”“碱”或“中”);若用PH计测定,则pH<7(填“>”“=”或“<”).
(3)向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH>7(填>,<,=),离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O.
分析 (1)A.向水中加入NaHSO4,电离产生氢离子,平衡正向移动,溶液呈酸性;
B.向水中加入NaCl,平衡不移动;
C.加热水至100℃,平衡正向移动,但溶液呈中性;
D.在水中加入KOH,平衡逆向移动,溶液呈碱性;
(2)在25℃时,水的pH=7,温度升高,则pH增大,水在任何温度下均为中性的,由此分析解答;
(3)假设SO42-的物质的量为2mol,判断完全反应需要其它离子的物质的量,进而书写反应的离子方程式,并判断溶液的酸碱性.
解答 解:(1)A.向水中加入NaHSO4 ,电离产生氢离子,平衡正向移动,溶液呈酸性,符合条件,故A正确;
B.向水中加入NaCl,平衡不移动,不符合条件,故B错误;
C.加热水至100℃,平衡正向移动,但溶液呈中性,不符合条件,故C错误;
D.在水中加入KOH,平衡逆向移动,溶液呈碱性,不符合条件,故D错误;
故选:A;
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,溶液呈中性,则试纸显淡黄色色,溶液显中性,若用PH计测定,则pH<7,故答案为:淡黄色;中;<
;
(3)假设SO42-的物质的量为2mol,则明矾溶液中含有2molSO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,反应后溶液呈碱性,pH>7,
故答案为:>;Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O.
点评 本题考查学生会的电离方面的知识和离子反应方程式的书写,明确信息中Al3+恰好沉淀、硫酸根离子完全沉淀是解答本题的关键,题目难度中等.

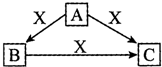 A、B、C、X均为中学化学常见的物质,一定条件下,它们有如下转化关系(部分产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见的物质,一定条件下,它们有如下转化关系(部分产物已略去),下列说法错误的是( )| A. | 若X为Cl2,则C可能为FeCl3 | |
| B. | 若X为KOH溶液,则A可能为AlCl3溶液 | |
| C. | 若X为Fe,则A可能为HNO3 | |
| D. | 若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2 |
| A. | 原子最外层电子数的周期性变化 | |
| B. | 原子半径呈现从大到小的周期性变化 | |
| C. | 元素化合价呈现周期性的变化 | |
| D. | 元素的金属性和非金属性呈现周期性的变化 |
| A. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有4种 | |
| B. | X、Y、Z可以形成离子化合物 | |
| C. | Y和Z分别形成的简单离子,其离子半径为Y>Z | |
| D. | Y和Z可以组成一种Y和Z的质量比为7:20的化合物 |
 某反应由两步反应 A、B、C 构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).回答下列问题
某反应由两步反应 A、B、C 构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).回答下列问题