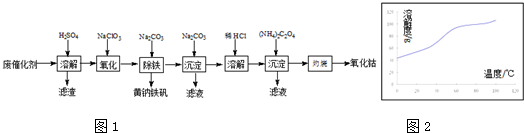
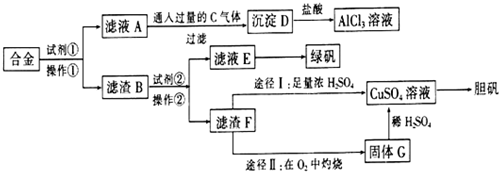
题目内容
5.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料.(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9;
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2?2NH3,实现储氢和输氢.下列说法正确的是cd;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH+4与PH+4、CH4、BH-4、ClO-4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.2+离子中,N原子是配位原子
(3)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为sp2杂化,SnBr2分子中 Sn-Br的
键角<120°(填“>”“<”或“=”).
(4)NiO 的晶体结构与氯化钠相同,在晶胞中镍离子的配位数是6. 已知晶胞的边长为 a nm,NiO 的摩尔质量为 b g•mol-1,NA为阿伏加德罗常数的值,则NiO 晶体的密度为$\frac{4b×1{0}^{21}}{{a}^{3}×{N}_{A}}$g•cm-3.
分析 (1)写出Ti2+核外电子排布式,判断其最高能层和该能层下的原子轨道数;
(2)a.根据价层电子对互斥理论确定杂化方式;
b.等电子体为原子数相等和价电子数相等的原子团;
c.分子间存在氢键的熔沸点高;
d.提供孤电子对的原子是配原子;
(3)先判断价层电子对数目判断杂化类型,中心原子的孤电子对对成键电子对有排斥作用进而判断分子中Sn-Br的键角;
(4)根据氯化钠型晶胞判断;已知晶胞的边长为 a nm,根据晶胞的密度ρ=$\frac{m}{V}$计算.
解答 解:(1)基态Ti2+价电子排布式为:3d2,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道,
故答案为:M;9;
(2)a.NH3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对是4,采用sp3杂化,故a错误;
b.等电子体为原子数相等和价电子数相等的原子团,NH+4与PH+4、CH4、BH-4均含有5个原子团,且价电子均为8,为等电子体,而ClO-4价电子数为32,不属于等电子体,故b错误;
c.分子间存在氢键的熔沸点高,相同压强时,氨气中含有氢键,PH3中不含氢键,所以NH3沸点比PH3高,故c正确;
d.提供孤电子对的原子是配原子,[Cu(NH3)4]2+离子中,N原子提供孤对电子,N原子为配原子,故d正确;
故答案为:cd;
(3)SnBr2分子中Sn原子价层电子对个数=2+$\frac{1}{2}$×(4-2×1)=3,所以Sn原子的轨道杂化方式为SP2杂化,且含有一个孤电子对,所以该分子为V形分子,孤电子对对成键电子对有排斥作用,所以其键角小于120°,
故答案为:sp2杂化;<;
(4)与NaCl晶胞类型一致,其配位数也为6;该晶胞的边长为a nm,则晶胞体积=a3 ×10-21cm3,根据均摊法可知,在NiO晶胞中含镍原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氧原子数为1+12×$\frac{1}{4}$=4,NiO的摩尔质量为b g•mol-1,所以晶胞的质量为$\frac{4×b}{{N}_{A}}$,所以晶胞的密度ρ=$\frac{m}{V}$=$\frac{4b}{a×1{0}^{-21}×{N}_{A}}$=$\frac{4b×1{0}^{21}}{{a}^{3}×{N}_{A}}$g•cm-3,
故答案为:6;$\frac{4b×1{0}^{21}}{{a}^{3}×{N}_{A}}$.
点评 本题考查物质结构与性质,涉及核外电子排布、杂化方式的判断、晶胞的计算等知识点,注意[Cu(NH3)4]2+离子的中心原子是提供空轨道的原子,题目难度中等.晶体密度的计算解题时注意均摊法运用和基本计算公式的运用.

 阅读快车系列答案
阅读快车系列答案| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 | |
| B. | 2 mol SO2(g)和1 mol O2(g)在密闭容器中充分反应,放出热量小于Q kJ | |
| C. | 增大压强或升高温度,该反应过程都能放出更多的热量 | |
| D. | 2 mol SO2(g)和1 mol O2(g)在密闭容器中充分反应,放出热量等于Q kJ |
| A. | 不可能是分解反应 | B. | 一定是置换反应 | ||
| C. | 可能是化合反应 | D. | 一定不是复分解反应 |
| A. | 配制盐酸溶液,用量筒取盐酸时俯视刻度线 | |
| B. | 配制盐酸溶液定容时,仰视容量瓶 | |
| C. | 称量4gNaOH配制0.20mol/L NaOH溶液500mL时,砝码错放左盘 | |
| D. | 配制NaOH溶液时,溶液未经冷却即注入容量瓶并定容至刻度线 |
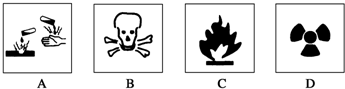
| A. | 浓硫酸----A图标 | B. | 酒精----B图标 | ||
| C. | 汽油----C图标 | D. | 放射性物品----D图标 |
| A. | 1molNH4+的质量为18g | |
| B. | SO2的摩尔质量为64g•mol-1 | |
| C. | 铝原子的摩尔质量等于它的相对原子质量 | |
| D. | 一个水分子的质量约等于$\frac{18}{6.02×1{0}^{23}}$g |