题目内容
1. 某反应由两步反应 A、B、C 构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).回答下列问题
某反应由两步反应 A、B、C 构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).回答下列问题(1)A→B 过程中的△H>(填“<”或“>”)0.
(2)加入催化剂不能(“能”或“不能”)改变反应的焓变.
(3)整个反应中△H=E1-E3-E4.
分析 A→B的反应,反应物总能量小于生成物总能量,反应吸热,B→C的反应,反应物的总能量大于生成物总能量,反应为放热反应,结合能量的高低解答该题,催化剂改变反应的活化能不改变化学反应的反应热,反应焓变.
解答 解:(1)A→B 过程中反应物总能量小于生成物总能量,反应为吸热反应,△H>0,故答案为:>;
(2)加入催化剂,只改变反应的活化能,不改变反应热,不能改变反应的焓变,故答案为:不能;
(3)整个反应中△H=(E1-E2)+(E2-E3)-E4=E1-E3-E4,故答案为:E1-E3-E4;
点评 本题考查化学反应与能量变化,题目难度不大,注意把握物质的总能量与反应热的关系,注意把握反应热的计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.有关Na2CO3和NaHCO3的叙述中正确的是( )
| A. | Na2CO3比NaHCO3热稳定性强 | |
| B. | 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同 | |
| C. | 相同温度下,Na2CO3的溶解度小于NaHCO3 | |
| D. | 物质的量浓度相同时,Na2CO3溶液的pH比NaHCO3溶液的小 |
6.下列说法正确的是( )
| A. | 煤经处理变为气体燃料的过程属于物理变化 | |
| B. | 往BaCl2溶液中通入少量CO2有白色沉淀生成 | |
| C. | 医用酒精、冰醋酸、液态HCl都是混合物 | |
| D. | 乙酸乙酯和一氯乙烷在一定条件下均可水解生成乙醇 |
10.对于有单质和化合物生成的反应,下列说法中正确的是( )
| A. | 不可能是分解反应 | B. | 一定是置换反应 | ||
| C. | 可能是化合反应 | D. | 一定不是复分解反应 |

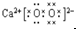 :和水反应的方程式为2CaO2+2H2O═2Ca(OH)2+O2↑;
:和水反应的方程式为2CaO2+2H2O═2Ca(OH)2+O2↑;
 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个1.0L密闭容器中,发生反应为:N2(g)+3H2(g)?2NH3(g)△H=a kJ/mol,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为33.3%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个1.0L密闭容器中,发生反应为:N2(g)+3H2(g)?2NH3(g)△H=a kJ/mol,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为33.3%.