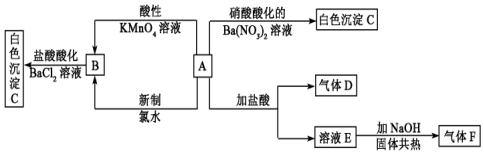
题目内容
14.醋酸钠水溶液pH> 7,(填“>”、“=”、“<”)原因是(用离子方程式表示):CH3COO-+H2O?CH3COOH+OH-.把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3.分析 CH3COO-是弱酸的阴离子,能水解 CH3COO-+H2O?CH3COOH+OH-溶液呈碱性;AlCl3溶液在加热时水解生成Al(OH)3,Al(OH)3在加热条件下分解生成Al2O3.
解答 解:CH3COO-是弱酸的阴离子,能水解 CH3COO-+H2O?CH3COOH+OH-溶液呈碱性,即溶液pH>7;AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,分解生成Al2O3.
故答案为:>;CH3COO-+H2O?CH3COOH+OH-;Al2O3.
点评 本题考查盐类水解的应用,题目难度不大,注意把握盐溶液蒸干、灼烧后产物的分析.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
9.下列有关有机物的说法正确的是( )
| A. | 甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种 | |
| B. | 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 | |
| C. | 苯与溴水混合,反复振荡后溴水层褪色,这是由于发生了取代反应 | |
| D. | 邻二甲苯只有一种结构,证明苯环中不存在碳碳单键和碳碳双键交替的结构 |
5.图Ⅰ、Ⅱ分别是甲、乙两组同学将反应AsO43-+2I-+2H+═AsO33-+I2+H2O设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.
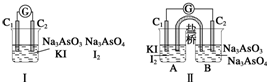
下列叙述正确的是( )

下列叙述正确的是( )
| A. | 甲组操作时,微安表指针不发生偏转 | |
| B. | 甲组操作时,溶液颜色不变 | |
| C. | 乙组操作时,C2作正极 | |
| D. | 乙组操作时,C1上发生的电极反应式为I2+2e-═2I- |
2.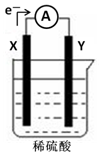 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 溶液中电子流向Y→X | |
| B. | 若两电极分别为铁和碳棒,则X为碳棒,Y为铁 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序为X>Y |
4.化学与人类生产、生活密切相关,下列有关说法不正确的是( )
| A. | “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 | |
| B. | 漂白粉解决了氯水漂白时不稳定、难以保存、使用不方便、效果不理想的问题 | |
| C. | 钢铁的腐蚀最普遍的是吸氧腐蚀,最终产物为铁锈 | |
| D. | 温度、压强一定时,放热且熵增的反应能自发进行 |
 ;写出蓝色沉淀溶解在氨水中的离子方程式Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
;写出蓝色沉淀溶解在氨水中的离子方程式Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.