题目内容
2.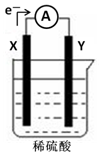 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 溶液中电子流向Y→X | |
| B. | 若两电极分别为铁和碳棒,则X为碳棒,Y为铁 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序为X>Y |
分析 根据图可知,该装置是原电池,根据电子的流向判断正负极,电流的流向正好与电子的流向相反;较活泼的金属作负极,不活泼的金属或导电的非金属作正极;负极上发生氧化反应,正极上发生还原反应.
解答 解:A、根据图片知该装置是原电池,外电路中电子从X电极流向Y电极,电流的流向与此相反,即Y→外电路→X,电子不通过内电路,只经过外电路,故A错误;
B、原电池中较活泼的金属作负极,较不活泼的金属或导电的非金属作正极,若两电极分别为Fe和碳棒,则Y为碳棒,X为Fe,故B错误;
C、X是负极,负极上发生氧化反应;Y是正极,正极上发生还原反应,故C错误;
D、原电池中活泼性强的金属为负极,所以两电极都是金属,则它们的活动性顺序为X>Y,故D正确;
故选D.
点评 本题考查了原电池原理,难度不大,会根据电子的流向判断原电池的正负极是解本题的关键,明确正负极的判断方法、正负极上发生反应的类型、电子和电流的流向即可解答本题.

练习册系列答案
相关题目
17.某温度时,Ag2SO4在水中的沉淀溶解曲线如图所示.该温度下,下列说法正确的是( )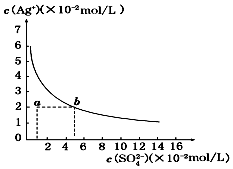

| A. | 含有大量SO42-的溶液中肯定不存在Ag+ | |
| B. | 0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合不会生成沉淀 | |
| C. | Ag2SO4的溶度积常数(Ksp)为1×10-3 | |
| D. | a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
18.能正确表示下列反应的离子方程式是( )
| A. | Cl2通入NaOH溶液:Cl2+OH-=Cl-+ClO-+H2O | |
| B. | NaHCO3溶液中加入稀HCl:CO32-+2H+=CO2↑+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | Cu溶于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
10.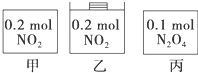 甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )
甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )
 甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )
甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )| A. | 平衡时各容器内n(NO2)的大小顺序为乙>甲>丙 | |
| B. | 平衡时NO2的百分含量:乙>甲=丙 | |
| C. | 平衡时甲中NO2与丙中N2O4的转化率一定相同 | |
| D. | 平衡时混合物的平均相对分子质量:乙>甲=丙 |
12.化学与生产、生活密切相关,下列表述错误的是:( )
| A. | 使用新能源,减少化石燃料的燃烧,可防止酸雨的产生 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 建设三峡大坝使用了大量水泥,水泥是使用量最大的无机非金属材料之一 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):