题目内容
18.对下列实验过程的评价,正确的是( )| A. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含有Cl- | |
| B. | 某溶液中先滴加稀硝酸酸化,再滴加几滴Ba(NO3)2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
分析 A.加入硝酸,防止生成AgOH沉淀;
B.可能含有SO32-;
C.紫色石蕊试液显红色,溶液呈酸性;
D.也可能为碳酸氢盐.
解答 解:A.加入硝酸,防止生成AgOH沉淀,加入硝酸银生成白色沉淀,可说明含有氯离子,故A正确;
B.如含有SO32-,有还原性,可被氧化生成SO42-,故B错误;
C.紫色石蕊试液显红色,溶液呈酸性,故C错误;
D.碳酸氢盐也可与盐酸反应生成无色气体,故D错误.
故选A.
点评 本题考查较为综合,涉及物质的检验和鉴别,为高频考点,侧重学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
2.下列分子均属于极性分子且中心原子均为sp3杂化的是( )
| A. | CH4、P4 | B. | SO2、CHCl3 | C. | PCl3、SO3 | D. | NH3、H2O |
9.氨基甲酸铵(NH2COONH4)是一种用途广泛的化工原料,其制备原理为:2NH3(g)+C02(g)?NH2C00NH4(s).实验室可用如图1所示装置制备: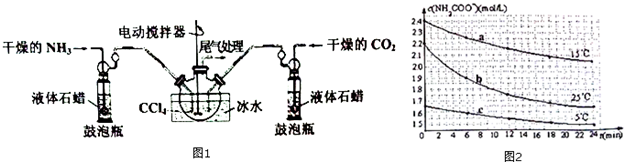
请回答下列问题:
(1)制备NH2COONH4的反应在一定条件下能自发进行,该反应的△H<0(填“>”“=”或“<”);要提高NH2COONH4的产率可采取的措施为增大压强、适当降低温度.
(2)装置中盛液体石蜡的鼓泡瓶作用是通过观察气泡,使气体流速均匀,调节NH3与CO2通入比例.
(3)一定条件下,在恒容密闭容器中通入体积比为2:1的NH3和CO2制备NH2COONH4固体.
①下列能说明反应达到平衡状态的是bd.
a、NH3和CO2物质的量之比为2:1
b.密闭容器中混合气体的密度不变
c、反应的焓变不变
d.固体的质量不在发生变化
②实验测得不同温度下达到平衡时气体的总浓度如表
30.0℃时该反应平衡常数K的计算式为$\frac{1}{(\frac{2}{3}×4.8×1{0}^{-3})^{2}×(\frac{1}{3}×4.8×1{0}^{-3})}$(不必计算结果)
(4)己知:NH2C00NH4+2H20?NH4HCO3+NH3•H2O.分别用三份不份不同初始浓度的NH2COONH4溶液测定不同温度下的水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.
①15℃时,0~6min内NH2COONH4水解反应的平均速率为0.05mol/(L•min).
②对比图中曲线a、b、c可知,水解反应速率最大的是b.

请回答下列问题:
(1)制备NH2COONH4的反应在一定条件下能自发进行,该反应的△H<0(填“>”“=”或“<”);要提高NH2COONH4的产率可采取的措施为增大压强、适当降低温度.
(2)装置中盛液体石蜡的鼓泡瓶作用是通过观察气泡,使气体流速均匀,调节NH3与CO2通入比例.
(3)一定条件下,在恒容密闭容器中通入体积比为2:1的NH3和CO2制备NH2COONH4固体.
①下列能说明反应达到平衡状态的是bd.
a、NH3和CO2物质的量之比为2:1
b.密闭容器中混合气体的密度不变
c、反应的焓变不变
d.固体的质量不在发生变化
②实验测得不同温度下达到平衡时气体的总浓度如表
| 温度(℃) | 20.0 | 30.0 | 40.0 |
| 平衡时气体总浓度 (×10-3mol•L-1) | 3.4 | 4.8 | 6.8 |
(4)己知:NH2C00NH4+2H20?NH4HCO3+NH3•H2O.分别用三份不份不同初始浓度的NH2COONH4溶液测定不同温度下的水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.
①15℃时,0~6min内NH2COONH4水解反应的平均速率为0.05mol/(L•min).
②对比图中曲线a、b、c可知,水解反应速率最大的是b.
13.下列有关说法正确的是( )
| A. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| B. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量 Cu(NO3)2溶液 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,降低温度时:v(正)增大,v (逆)减小,平衡时氢气转化率增大 | |
| D. | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反 应的△S<0 |
3.理想的原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放,符合绿色化学的概念.下列反应类型中完全符合要求的是( )
| A. | 分解反应 | B. | 置换反应 | C. | 复分解反应 | D. | 化合反应 |
10.下列分离提纯所选用的试剂正确的是( )
| A. | 除去O2中混有的N2:选用灼热的铜网 | |
| B. | 提取碘水中的碘单质:选用有机试剂苯 | |
| C. | 除去CO2中混有的CO:选用适量澄清石灰水 | |
| D. | 除去Mg粉中混有的MgO:选用过量稀盐酸 |
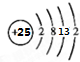 ,其最高正价为+7;是第四周期ⅦB族.
,其最高正价为+7;是第四周期ⅦB族.


