题目内容
15.下列说法不正确的是( )| A. | 除去CO2中少量SO2气体,可将气体通过饱和碳酸氢钠溶液洗气 | |
| B. | 除去乙醇中含有的少量水,可加入生石灰,然后进行蒸馏 | |
| C. | 滴定管使用前需要检漏,装溶液时需要润洗 | |
| D. | 除去乙酸乙酯中的少量乙酸,可加入饱和碳酸钠溶液除去乙酸,再进行蒸馏 |
分析 A.二氧化硫与碳酸氢钠反应生成二氧化碳;
B.CaO与水反应后,增大与乙醇的沸点差异;
C.滴定管装液前需要润洗;
D.乙酸与碳酸钠反应后,与乙酸乙酯分层.
解答 解:A.二氧化硫与碳酸氢钠反应生成二氧化碳,则将气体通过饱和碳酸氢钠溶液洗气可除杂,故A正确;
B.CaO与水反应后,增大与乙醇的沸点差异,则加入生石灰,然后进行蒸馏可分离,故B正确;
C.滴定管装液前需要润洗,否则浓度偏小故C正确;
D.乙酸与碳酸钠反应后,与乙酸乙酯分层,然后利用分液分离,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
5.如表实验操作正确且能达到预期目的是( )
| 实验目的 | 操作 | |
| A | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液 |
| B | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| C | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| D | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| A. | A | B. | B | C. | C | D. | D |
6.X、Y、Z、W属于短周期主族元素.X元素的原子半径最大,Y元素的最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子核外电子数之比为2:1,下列说法中错误的是( )
| A. | X与Y形成的两种化合物中阴阳离子个数比为1:2 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 | |
| C. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物熔沸点低 | |
| D. | Z、W、R的最高价氧化物对应水化物的酸性强弱顺序是R>W>Z |
10.常温下,向20mL 0.1mol/LHA(一种弱酸)溶液中加入10mL 0.1mol/LNaOH溶液,充分反应后,有关溶液中微粒浓度关系不正确的是( )
| A. | 若溶液pH=7,则c(A-)=c(HA) | |
| B. | 若c(A-)>c(HA),则溶液中水电离的c(H+)<1.0×10-7mol/L | |
| C. | 若pH>7,加水稀释c(A-)/c(HA)增大 | |
| D. | 溶液中,c(A-)=2c(H+)+c(HA)-2c(OH-) |
20.①25℃,两种酸的电离平衡常数如表.
HSO3-的电离平衡常数表达式K=$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$.
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?
7.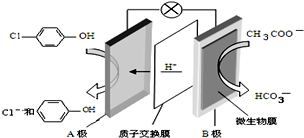 污水治理越来越引起人们重视,可以通过膜电池除去废水
污水治理越来越引起人们重视,可以通过膜电池除去废水 中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的( )
中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的( )
 污水治理越来越引起人们重视,可以通过膜电池除去废水
污水治理越来越引起人们重视,可以通过膜电池除去废水 中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的( )
中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的( )| A. | A为电池的正极,发生还原反应 | |
| B. | 电流方向从B极沿导线经小灯泡流向A极 | |
| C. | A极的电极反应式为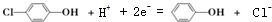 | |
| D. | 当外电路中有0.2mole-转移时,进入A极区的H+的个数为0.2NA |
7.甲小组以H2O2分解为例,探究外界条件对反应速率的影响.在常温下按照下表所示的方案完成实验.
(1)实验①和②的目的是浓度对化学反应速率的影响.进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是相同温度的水浴加热或加入相同量的MnO2等催化剂(填一种即可).
(2)利用实验②和③可知加入FeCl3溶液可以催化H2O2分解,已知FeCl3溶液中含有H2O、Fe3+和Cl-三种粒子,为探究哪种粒子具有催化作用,有如下三种猜想:
猜想1:真正催化分解H2O2的是FeCl3溶液中的H2O
猜想2:真正催化分解H2O2的是FeCl3溶液中的Fe3+
猜想3:真正催化分解H2O2的是FeCl3溶液中的Cl-
你认为最不可能的是猜想1;理由是因过氧化氢溶液中自身有水,可见水不是催化剂.
(3)同学们又对余下的两种猜想进行了实验探究,请你帮助他们填写下表:
乙小组通过Na2S2O3与0.1mol•L-1 H2SO4反应溶液浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下:
(4)已知:反应中除生成淡黄色沉淀外还会生成刺激性气味的气体,写出反应离子方程式:S2O32-+2H+=S↓+SO2↑+H2O;
(5)若同时选择实验①②、实验①③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中b为10mL.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
(2)利用实验②和③可知加入FeCl3溶液可以催化H2O2分解,已知FeCl3溶液中含有H2O、Fe3+和Cl-三种粒子,为探究哪种粒子具有催化作用,有如下三种猜想:
猜想1:真正催化分解H2O2的是FeCl3溶液中的H2O
猜想2:真正催化分解H2O2的是FeCl3溶液中的Fe3+
猜想3:真正催化分解H2O2的是FeCl3溶液中的Cl-
你认为最不可能的是猜想1;理由是因过氧化氢溶液中自身有水,可见水不是催化剂.
(3)同学们又对余下的两种猜想进行了实验探究,请你帮助他们填写下表:
| 实验步骤 | 实验现象 | 实验结论 |
| 向盛有5mL 15%的H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中. | 无明显现象 | ①Cl-不具有催化作用或猜想3不正确 |
| 向盛有5mL 15%的H2O2溶液的试管中加入少量的FeCl3固体,然后把带火星的木条伸入试管中. | ②试管中有大量气泡产生,带火星的木条复燃 | ③Fe3+具有催化作用或猜想2正确 |
| 实验编号 | 温度/℃ | Na2S2O3 | V(H2SO4)/mL | V(H2O)/mL | |
| c/mol•L-1 | V/mL | ||||
| ① | 25 | 0.1 | 5.0 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 10.0 | 0 |
| ③ | 25 | 0.1 | 5.0 | 5.0 | b |
(5)若同时选择实验①②、实验①③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中b为10mL.
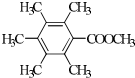
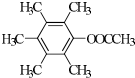
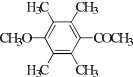
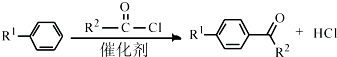 (R1、R2代表烷基)
(R1、R2代表烷基)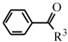 +ClCH2COOR4+R4ONa→
+ClCH2COOR4+R4ONa→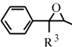 COOR4+R4OH+NaCl(R3、R4代表烷基)
COOR4+R4OH+NaCl(R3、R4代表烷基)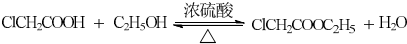 .
. .
.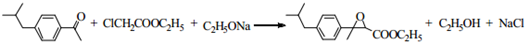 .
. 、
、 、
、 .
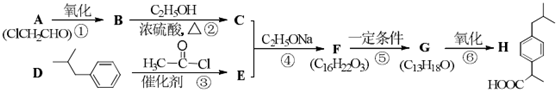
. 某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有( )
某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有( )