题目内容
1.下列除杂操作正确的是( )| 物质 | 杂质 | 试剂 | 提纯方法 | |
| A | 苯 | 苯酚 | 溴水 | 分液 |
| B | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
| C | 甲烷 | 乙烯 | 酸性高锰酸钾溶液 | 洗气 |
| D | 甲醛 | 甲酸 | 稀氢氧化钠溶液 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溴、三溴苯酚均易溶于苯;
B.二者均与碳酸钠溶液反应;
C.乙烯被高锰酸钾氧化生成二氧化碳;
D.甲酸与NaOH反应后,增大与甲醛的沸点差异.
解答 解:A.溴、三溴苯酚均易溶于苯,不能除杂,应加NaOH溶液、分液,故A错误;
B.二者均与碳酸钠溶液反应,不能除杂,应选饱和碳酸氢钠溶液、洗气,故B错误;
C.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,应选溴水、洗气,故C错误;
D.甲酸与NaOH反应后,增大与甲醛的沸点差异,然后蒸馏可除杂,故D正确;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
相关题目
9.五种短周期元素在元素周期表中的位置如图所示,其中X元素最高正化合价与最低负化合价的代数和为0,下列判断正确的是( )
| X | |||||
| Z | Y | M | N |
| A. | 原子半径:Y>X | |
| B. | 阴离子还原性:N>M | |
| C. | 最高价氧化物对应水化物的碱性:Y>Z | |
| D. | 气态氢化物稳定性:M>N |
6.聚乙炔能够导电,下列关于聚乙炔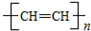 和聚合物A
和聚合物A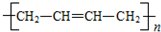 的说法中正确的是( )
的说法中正确的是( )
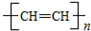 和聚合物A
和聚合物A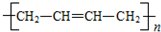 的说法中正确的是( )
的说法中正确的是( )| A. | 两种聚合物的单体互为同系物 | |
| B. | 聚合物A不属于单双键交错的结构. | |
| C. | 聚合物A的相对分子质量是聚乙炔的两倍 | |
| D. | 两种聚合物的单体各1 mol,分别与Br2发生加成反应时最多消耗Br2的物质的量之比为2:1 |
13.下列说法正确的是( )
| A. | 在紫外线、饱和Na2SO4、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性 | |
| B. | 油脂属于高分子化合物,是混合物 | |
| C. | 在一定条件下,氨基酸之间能发生反应,合成更加复杂的化合物 | |
| D. | 检验淀粉在稀硫酸催化条件下水解产物的方法是:取适量水解液于试管中,加入少量新制Cu(OH)2悬浊液,加热,观察是否有砖红色沉淀 |
10.在Na+浓度为0.9mol•L-1的某澄清溶液中,还可能含有下表中的若干种离子:
取该溶液100ml进行如下实验(气体体积在标准状况下测定):
I.向该溶液中加入足量稀HCl,产生白色沉淀并放出1.12L气体
II.将I的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称得固体质量为3.6g
III.在II的滤液中滴加BaCl2溶液,无明显现象
下列说法不正确的是( )
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
I.向该溶液中加入足量稀HCl,产生白色沉淀并放出1.12L气体
II.将I的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称得固体质量为3.6g
III.在II的滤液中滴加BaCl2溶液,无明显现象
下列说法不正确的是( )
| A. | K+一定存在,且c(K+)≤1.3mol•L-1 | |
| B. | 实验I能确定一定不存在的离子是Ag+、Mg2+、Ba2+ | |
| C. | 实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓ | |
| D. | 实验III能确定一定不存在SO42- |
13.制备下列气体过程中,净化除杂的有关操作(括号内是杂质),正确的是( )
| A. | CO2(CO):气体通过灼热的CuO | |
| B. | Cl2(SO2):通入盛有品红溶液的洗气瓶 | |
| C. | NO(NO2):通过水洗,再干燥后,用向下排空气法收集 | |
| D. | H2(CO2):依次通过盛有氢氧化钠溶液和浓硫酸的洗气瓶 |

