题目内容
12.硫酸是重要的化工原料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g)?2SO3(g)达到平衡状态.
①从平衡角度分析采用过量O2的目的是提高二氧化硫的转化率;判断该反应达到平衡状态的标志是bc.(填字母)
a.SO2和SO3 浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
②该反应的平衡常数表达式为:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$.
③已知:K(300℃)>K(450℃),该反应是放热反应.若反应温度升高,SO2的转化率减小 (填“增大”、“减小”或“不变”).
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图1所示.平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”,下同).

(3)如图2所示,保持温度不变,将2mol SO2和1mol O2加入甲容器中,将4mol SO3加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍.
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲<乙.
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲>乙.
分析 (1)①采用过量的O2,可以提高二氧化硫转化率;达平衡时各组分的浓度保持不变;
②平衡常数等于生成物浓度幂之积比上反应浓度幂之积,即K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$;
③已知:K(300℃)>K(450℃),升高温度平衡常数减小,说明平衡逆向移动,而升高温度平衡向吸热反应方向移动;
(2)平衡常数只受温度影响,温度不变,平衡常数不变;
(3)①甲为恒温恒容容器,若移动活塞P,使乙的容积和甲相等,为恒温恒容容器,乙中加入4mol三氧化硫相当于加入2mol三氧化硫,再加入2mol三氧化硫,增大压强,平衡正向进行,SO3的体积分数增大;
②甲为恒温恒容容器,加入氦气总压增大,分压不变,平衡不变,乙中加入氦气为保持恒压,体积增大,压强减小,平衡逆向进行,达到新平衡时,SO3的体积分数减小.
解答 解:(1)①从平衡角度分析采用过量O2的目的是,利用廉价原料提高物质转化率,加入氧气提高二氧化硫的转化率,
a.SO2和SO3 浓度不变,不一定相等,故错误;
b.SO2 百分含量保持不变,说明反应达平衡状态,故正确;
c.容器中气体的压强不变,说明气体的物质的量不变反应达平衡状态,故正确;
d.只要反应发生就符合,SO3的生成速率与SO2的消耗速率相等,故错误;
故答案为:提高二氧化硫的转化率; bc;
②平衡常数等于生成物浓度幂之积比上反应浓度幂之积,即K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$,故答案为:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$;
③K(300℃)>K(450℃),说明温度越高平衡常数越小,反应逆向进行,升温平衡向吸热反应方向进行,正反应为放热反应,升温平衡逆向进行,二氧化硫转化率减小,
故答案为:放;减小;
(2)平衡常数只受温度影响,与压强无关,平衡状态由A变到B时,二者温度相同,故平衡常数K(A)=K(B),故答案为:=;
(3)将2mol SO2和1mol O2加入甲容器中,将4mol SO3加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍,可知甲、乙中最后达到相同的平衡状态;
①若移动活塞P,使乙的容积和甲相等,增大压强,平衡正向进行,SO3的体积分数增大,SO3的体积分数甲<乙,
故答案为:<;
②甲为恒温恒容容器,加入氦气总压增大,分压不变,平衡不变,乙中加入氦气,为保持恒压,体积增大,压强减小,平衡逆向进行,达到新平衡时,SO3的体积分数减小,SO3的体积分数甲大于乙,
故答案为:>.
点评 本题考查化学平衡常数、化学平衡计算与影响因素,题目难度中等,注意平衡常数在计算中的应用,(3)中关键是构建等效平衡建立途径.

 阅读快车系列答案
阅读快车系列答案| A. | 1s22s22p3 | B. |  | C. |  | D. |  |
| A. | CO32-离子是弱酸根,开始阶段与H+结合,生成HCO3- | |
| B. | 溶液中的Na+、Cl-抑制了CO2生成 | |
| C. | 开始生成的CO2与Na2CO3反应,生成了NaHCO3 | |
| D. | CO32-离子在水中,存在两个水解平衡,开始阶段可能是H+结合OH-,生成HCO3- |
| A. | 苯和植物油 | B. | 乙酸乙酯与饱和碳酸钠溶液 | ||
| C. | 甘油和水 | D. | 苯和液溴 |
| A. | 碘单质-分子晶体 | B. | 铝铜铁合金-准晶体 | ||
| C. | 石墨-原子晶体 | D. | 氧化镁-离子晶体 |
| A. | 0.25a | B. | 0.35a | C. | 0.45a | D. | 0.50a |
| A. | 8,18,32,32 | B. | 8,18,18,32 | C. | 8,18,18,18 | D. | 8,8,18,18 |
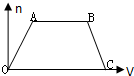 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,图中AB段表示的离子方程式先后顺序正确的是( )
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,图中AB段表示的离子方程式先后顺序正确的是( )