题目内容
 某化学反应2A(g)
某化学反应2A(g)| 催化剂 |
| 实验 序号 |
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.85 | 0.71 | 0.68 | 0.58 | 0.50 | 0.50 |
| 3 | 820℃ | 2.0 | 0.90 | 0.65 | 0.60 | 0.60 | 0.60 | 0.60 |
A.在恒温恒容的容器中,气体的密度不再变化;
B.在恒温恒压的容器中,物质A的体积分数不再变化;
C.在恒温恒压的容器中,物质A、B的浓度之比保持不变;
D.在绝热恒容的容器(与外界不发生能量交换)中,容器内压强不再变化;
(2)实验1中,10至20分钟时间内A的平均反应速率
(3)实验2中,隐含的反应条件可能是
(4)写出该反应的平衡常数表达式
(5)如图为实验1时,物质D浓度随时间的变化曲线图,试在该图中添加820℃时(其他反应条件与实验1相同),物质D浓度随时间的变化曲线
考点:化学平衡状态的判断,反应速率的定量表示方法,化学平衡常数的含义,化学反应速率的影响因素,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)此可逆反应的特点为:反应前后气体的体积不变,气体总质量不变.在恒温恒容的容器中进行时,气体总压强始终保持不变、气体的密度始终保持不变;在恒温恒压的容器中,气体的总体积保持不变;在绝热恒容的容器中进行时,温度变化,压强随之变化;
(2)从表中计算出A的浓度的变化值,代入速率公式计算;
(3)实验2与实验1相比达到平衡的速率减小,平衡相同,压强改变对平衡无影响;
(4)由实验2和实验3中浓度比较可以得出A的转化率增大的结论,以此判断平衡移动的方向;
(5)820℃与800℃相比,速率增大,平衡时间减小10分钟,平衡时D的浓度大,以此画图,斜率大,平衡早.
(2)从表中计算出A的浓度的变化值,代入速率公式计算;
(3)实验2与实验1相比达到平衡的速率减小,平衡相同,压强改变对平衡无影响;
(4)由实验2和实验3中浓度比较可以得出A的转化率增大的结论,以此判断平衡移动的方向;
(5)820℃与800℃相比,速率增大,平衡时间减小10分钟,平衡时D的浓度大,以此画图,斜率大,平衡早.
解答:
解:(1)A、在恒温恒容的容器中,气体的体积不变,气体的总质量不变,根据ρ=
可知密度不变,故A错误;
B、在恒温恒压的容器中,气体的总体积保持不变,A的体积分数不再变化说明A的物质的量保持不变,故B正确;
C、在恒温恒压的容器中,物质A、B的浓度之比保持不变,而A是反应物,B是生成物,说明A、B的浓度保持不变,故C正确;
D、在绝热恒容的容器中进行时,温度变化,压强随之变化,当压强不再变化时,说明达到了化学平衡,故D正确;
故答案为:BCD;
(2)10至20分钟内A的浓度变化为0.80mol/L-0.67mol/L=0.13mol/L,v(A)=
=
=0.013mol/(L?min),故答案为:0.013mol/(L?min);
(3)实验2与实验1相比达到平衡的速率减小,化学平衡相同,对于此反应而言,压强改变对平衡无影响,减小压强可以减小化学反应速率,不使用催化剂可以减小化学反应速率,因此隐含的条件是减小压强或未使用催化剂,
故答案为:减小压强或未使用催化剂;
(4)K=
,实验2中800℃条件下,A的平衡转化率=
×100%=50%,实验3中820℃条件下,A的平衡转化率=
×100%=70%,说明升高温度A的转化率增大,因此平衡正向移动,
故答案为:K=
;正;
(5)820℃与800℃相比,速率增大,平衡时间减小10分钟,平衡时D的浓度大,作图为: ,
,
故答案为: .
.
| m |
| V |
B、在恒温恒压的容器中,气体的总体积保持不变,A的体积分数不再变化说明A的物质的量保持不变,故B正确;
C、在恒温恒压的容器中,物质A、B的浓度之比保持不变,而A是反应物,B是生成物,说明A、B的浓度保持不变,故C正确;
D、在绝热恒容的容器中进行时,温度变化,压强随之变化,当压强不再变化时,说明达到了化学平衡,故D正确;
故答案为:BCD;
(2)10至20分钟内A的浓度变化为0.80mol/L-0.67mol/L=0.13mol/L,v(A)=
| △c(A) |
| △t |
| 0.13mol/L |
| 10min |
(3)实验2与实验1相比达到平衡的速率减小,化学平衡相同,对于此反应而言,压强改变对平衡无影响,减小压强可以减小化学反应速率,不使用催化剂可以减小化学反应速率,因此隐含的条件是减小压强或未使用催化剂,
故答案为:减小压强或未使用催化剂;
(4)K=
| c(B)?c(D) |
| c2(A) |
| 1.0mol/L-0.5mol/L |
| 1.0mol/L |
| 2.0mol/L-0.6mol/L |
| 2.0mol/L |
故答案为:K=
| c(B)?c(D) |
| c2(A) |
(5)820℃与800℃相比,速率增大,平衡时间减小10分钟,平衡时D的浓度大,作图为:
 ,
,故答案为:
 .
.
点评:本题考查平衡状态的判定、化学平衡影响因素、化学平衡常数表达式,难点在于由表中数据的准确的判断出化学平衡移动的方向,整体难度较大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案
相关题目
短周期元素X、Y、Z、W的原子序数依次增大,且最外层电子数之和为12.X与Z同主族,X与Y分属不同周期,Y原予的最外层电子数是电子层数的3倍,W原子的最外层电子数是次外层电子数的一半.下列说法中正确的是( )
| A、原子半径:Y<Z<W |
| B、气态氢化物的稳定性:Y<W |
| C、X与Y只能形成一种化合物 |
| D、Z2WY3可用来制备木材防火剂 |
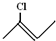 表示的分子式
表示的分子式 的键线式的表达式
的键线式的表达式 有的官能团的名称分别为
有的官能团的名称分别为

 碘及其化合物在人类活动中占有重要地位.
碘及其化合物在人类活动中占有重要地位.