题目内容
如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为 ;
(2)地壳中含量最多的金属元素是 ,写出元素②④以原子个数比1:2形成化合物的电子式 .
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是 ;
(4)写出③、⑦、⑧对应的简单离子的还原性由强到弱的次序 .
(5)②和⑥组成的化合物属于 晶体(填写晶体类型).
| 周期 族 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
(2)地壳中含量最多的金属元素是
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是
(4)写出③、⑦、⑧对应的简单离子的还原性由强到弱的次序
(5)②和⑥组成的化合物属于
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是N、O、F、Na、Al、Si、S、Cl、Ar、K元素,
(1)在这些元素中,化学性质最不活泼的原子是Ar;
(2)地壳中含量最多的金属元素是Al,元素②④以原子个数比1:2形成化合物是Na2O;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性最强,元素的金属性越强,其最高价氧化物的水化物碱性越强;
(4)元素的非金属性越弱,其简单阴离子的还原性越强;
(5)②和⑥组成的化合物是SiO2,根据构成微粒判断晶体类型.
(1)在这些元素中,化学性质最不活泼的原子是Ar;
(2)地壳中含量最多的金属元素是Al,元素②④以原子个数比1:2形成化合物是Na2O;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性最强,元素的金属性越强,其最高价氧化物的水化物碱性越强;
(4)元素的非金属性越弱,其简单阴离子的还原性越强;
(5)②和⑥组成的化合物是SiO2,根据构成微粒判断晶体类型.
解答:
解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是N、O、F、Na、Al、Si、S、Cl、Ar、K元素,
(1)在这些元素中,化学性质最不活泼的原子是Ar,其原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)地壳中含量最多的金属元素是Al,元素②④以原子个数比1:2形成化合物是Na2O,氧化钠是离子化合物,其构成微粒为钠离子和氧离子,其电子式为: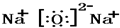 ,故答案为:Al;
,故答案为:Al;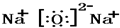 ;
;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性最强,O和F元素虽然非金属性较强,但O和F元素没有最高价氧化物,其次非金属性最强的元素是Cl元素,氯元素最高价氧化物的水化物酸性最强的是HClO4,元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性最强的元素是K元素,则KOH的碱性最强,故答案为:HClO4;KOH;
(4)元素的非金属性越弱,其简单阴离子的还原性越强,这几种元素非金属性强弱顺序是F>Cl>S,所以其简单阴离子还原性强弱顺序是S2->Cl->F-,故答案为:S2->Cl->F-;
(5))②和⑥组成的化合物是SiO2,二氧化硅的构成微粒是原子,所以二氧化硅属于原子晶体,故答案为:原子.
(1)在这些元素中,化学性质最不活泼的原子是Ar,其原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(2)地壳中含量最多的金属元素是Al,元素②④以原子个数比1:2形成化合物是Na2O,氧化钠是离子化合物,其构成微粒为钠离子和氧离子,其电子式为:
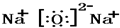 ,故答案为:Al;
,故答案为:Al;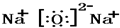 ;
;(3)元素的非金属性越强,其最高价氧化物的水化物酸性最强,O和F元素虽然非金属性较强,但O和F元素没有最高价氧化物,其次非金属性最强的元素是Cl元素,氯元素最高价氧化物的水化物酸性最强的是HClO4,元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性最强的元素是K元素,则KOH的碱性最强,故答案为:HClO4;KOH;
(4)元素的非金属性越弱,其简单阴离子的还原性越强,这几种元素非金属性强弱顺序是F>Cl>S,所以其简单阴离子还原性强弱顺序是S2->Cl->F-,故答案为:S2->Cl->F-;
(5))②和⑥组成的化合物是SiO2,二氧化硅的构成微粒是原子,所以二氧化硅属于原子晶体,故答案为:原子.
点评:本题考查了元素周期表和元素周期律的综合应用,根据元素在周期表中的位置确定元素,再结合物质结构、元素周期律解答,熟练掌握元素周期律的内涵,总结规律形成知识网络,难度中等.

练习册系列答案
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
用 NA示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA |
| B、标准状况下,22.4LH2O 含有的水分子数为NA |
| C、通常状况下,NA个CO2分子占有的体积为22.4L |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中含有Cl-个数为NA |
某金属元素R的硝酸盐R(NO3)n溶液用Pt电极电解,阳极产生气体VL(标准状况)时,阴极质量增加mg,若R的原子量为M,下列叙述中不正确的是( )
A、电路中通过电子
| ||
B、n=
| ||
C、溶液中H+增加
| ||
D、n=
|
下列实验操作及结论合理的是( )
| A、用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
| B、用盐酸标准溶液滴定待测的氢氧化钠溶液时,酸式滴定管尖嘴处开始有气泡,滴后气泡消失,会使测定结果偏低 |
| C、用湿润pH试纸测溶液pH时,应用滴管取液滴在试纸上,再与标准比色卡对比 |
| D、取a克Na2CO3和NaHCO3混合物于锥形瓶中加适量水溶解,酚酞作指示剂,用c mol?L-1的标准盐酸滴定,可测定混合物中Na2CO3的质量分数 |
 某化学反应2A(g)
某化学反应2A(g)
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: