题目内容
X、Y、Z、W、E五种短周期元素在元素周期表的位置如图.其中W的原子序数是Y的2倍.
(1)能证明X、Z两元素非金属性强弱的离子方程式为
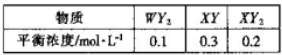
(2)-定条件下,在恒容容器中,充人一定量的WY2(g)和XY (g),发生反应:WY2(g)+2XY(g)?2XY2(g)+W(l).T1℃时,各物质的平衡浓度如下表:
①若温度升高到 T2℃时,反应的平衡常数为6.64,则该反应的逆反应为 反应
(填“吸热”或“放热”).
②其他条件不变,若该反应在恒压条件下进行,平衡时XY的转化率a2 a1(T1℃时的转化率)(填“<”“>”“=”)
(3)室温下,Mg(OH)2饱和溶液 (填“能”或“不能”)使石蕊试液变蓝,通过计算说明原因(已知:Ksp[Mg(OH)2]=4.0×10-12,lg5=0.7).答
(4)化学反应E2+3H2?2EH3;△H<0在工业生产中有重要的地位,若要提高E2的转化率,可采取的措施是 (填字母代号)
a.升高温度 b.加催化剂 c.增加H2的浓度 d.分离出EH3
一定条件下,1molE2与3molH2在密闭容器中反应达到平衡,E2的转化率为25%且放出23.lkJ能量,则该条件下反应的热化学反应方程式为 .
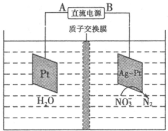
(5)电化学降解法可用于治理水中硝酸盐的污染,其原理如图所示.其中B为电源的 极,其电极反应式为 .
| X | E | Y |
| Z | W |
(2)-定条件下,在恒容容器中,充人一定量的WY2(g)和XY (g),发生反应:WY2(g)+2XY(g)?2XY2(g)+W(l).T1℃时,各物质的平衡浓度如下表:
①若温度升高到 T2℃时,反应的平衡常数为6.64,则该反应的逆反应为
(填“吸热”或“放热”).

②其他条件不变,若该反应在恒压条件下进行,平衡时XY的转化率a2
(3)室温下,Mg(OH)2饱和溶液
(4)化学反应E2+3H2?2EH3;△H<0在工业生产中有重要的地位,若要提高E2的转化率,可采取的措施是
a.升高温度 b.加催化剂 c.增加H2的浓度 d.分离出EH3
一定条件下,1molE2与3molH2在密闭容器中反应达到平衡,E2的转化率为25%且放出23.lkJ能量,则该条件下反应的热化学反应方程式为
(5)电化学降解法可用于治理水中硝酸盐的污染,其原理如图所示.其中B为电源的

考点:位置结构性质的相互关系应用,热化学方程式,难溶电解质的溶解平衡及沉淀转化的本质,电解原理
专题:
分析:X、Y、Z、W、E五种短周期元素在元素周期表的位置如图,则X、E、Y处于第二周期,Z、W处于第三周期;W的原子序数是Y的2倍,设Y的原子序数为x,则Y的原子序数为:x+8=2x,解得:x=8.则Y为O元素、W为S元素,结合各元素在周期表中的相对位置可知,E为N元素、X为C元素、Z为Si元素,
(1)非金属性越强,对应的最高价氧化物的水化物的酸性越强;
(2)①计算出T1℃时的平衡常数,然后判断该反应热;
②根据压强对该反应的影响判断转化率大小;
(3)根据氢氧化镁的溶度积计算出饱和溶液中氢氧根离子浓度,然后判断溶液是否变蓝;
(4)根据合成氨反应原理及影响化学平衡的因素判断;计算出1mol氮气完全反应放出的热量,然后写出该反应的热化学方程式;
(5)根据电解原理、原电池工作原理判断两极,然后写出电极反应式.
(1)非金属性越强,对应的最高价氧化物的水化物的酸性越强;
(2)①计算出T1℃时的平衡常数,然后判断该反应热;
②根据压强对该反应的影响判断转化率大小;
(3)根据氢氧化镁的溶度积计算出饱和溶液中氢氧根离子浓度,然后判断溶液是否变蓝;
(4)根据合成氨反应原理及影响化学平衡的因素判断;计算出1mol氮气完全反应放出的热量,然后写出该反应的热化学方程式;
(5)根据电解原理、原电池工作原理判断两极,然后写出电极反应式.
解答:
解:X、Y、Z、W、E五种短周期元素在元素周期表的位置如图,则X、E、Y处于第二周期,Z、W处于第三周期;W的原子序数是Y的2倍,设Y的原子序数为x,则Y的原子序数为:x+8=2x,解得:x=8.则Y为O元素、W为S元素,结合各元素在周期表中的相对位置可知,E为N元素、X为C元素、Z为Si元素,
(1)最高价氧化物对应的水化物酸性越强,则非金属性越强,根据反应SiO32-+CO2+H2O=H2SiO3↓+CO32-可以证明C的非金属性大于Si,
故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-;
(2)①T1℃时K=
=4.44,由T2℃时反应的平衡常数为6.64,可知升高温度,平衡正向移动,则该反应为吸热反应,逆反应为放热反应,
故答案为:放热;
②该反应的正反应为体积缩小的反应,增大压强平衡向着正向移动,则CO的转化率增大,即:a2>a1,
故答案为:>;
(3)Ksp[Mg(OH)2]=c(OH-)2?c(Mg2+)=4.0×10-12,设c(Mg2+)为x,则Ksp=c(OH-)2?c(Mg2+)=x3=4.0×10-12,x=
=10-4mol/L,c(OH-)=2x=2×10-4mol/L,pH=10.3,溶液显示碱性,故可以变蓝,
故答案为:能;c(OH-)=2×10-4mol/L,pH=10.3,故可以变蓝;
(4)E2为N2,化学反应N2+3H2?2NH3;△H<0,若要提高氮气的转化率,需要使反应向着正向移动,该反应为放热反应,则需要降低温度,也可以分离出氨气,还可以增加氢气的浓度,所以cd正确;
1molN2与3molH2在密闭容器中反应达到平衡,N2的转化率为25%且放出23.lkJ能量,则1mol氮气完全反应放出的热量为:23.1kJ×4=92.4kJ,所以该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,
故答案为:cd;N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
(5)由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,所以阴极上发生的电极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-,
故答案为:负极;2NO3-+6H2O+10e-=N2↑+12OH-.
(1)最高价氧化物对应的水化物酸性越强,则非金属性越强,根据反应SiO32-+CO2+H2O=H2SiO3↓+CO32-可以证明C的非金属性大于Si,
故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-;
(2)①T1℃时K=
| (0.2)2 |
| 0.1×(0.3)2 |
故答案为:放热;
②该反应的正反应为体积缩小的反应,增大压强平衡向着正向移动,则CO的转化率增大,即:a2>a1,
故答案为:>;
(3)Ksp[Mg(OH)2]=c(OH-)2?c(Mg2+)=4.0×10-12,设c(Mg2+)为x,则Ksp=c(OH-)2?c(Mg2+)=x3=4.0×10-12,x=
| 3 |
| ||
故答案为:能;c(OH-)=2×10-4mol/L,pH=10.3,故可以变蓝;
(4)E2为N2,化学反应N2+3H2?2NH3;△H<0,若要提高氮气的转化率,需要使反应向着正向移动,该反应为放热反应,则需要降低温度,也可以分离出氨气,还可以增加氢气的浓度,所以cd正确;
1molN2与3molH2在密闭容器中反应达到平衡,N2的转化率为25%且放出23.lkJ能量,则1mol氮气完全反应放出的热量为:23.1kJ×4=92.4kJ,所以该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,
故答案为:cd;N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
(5)由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,所以阴极上发生的电极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-,
故答案为:负极;2NO3-+6H2O+10e-=N2↑+12OH-.
点评:本题考查了位置、结构与性质的关系,题目难度中等,试题涉及元素推断、电解原理与原电池工作原理、热化学方程式书写、难溶物溶度积的计算、化学平衡及其影响等知识,试题知识点较多、综合性较强,充分考查了学生灵活应用基础知识的能力.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
 在容积固定的密闭容器中存在如下反应:N2(g)+3H2(g)?2NH3(g);△H<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如图关系图:下列叙述正确的是( )
在容积固定的密闭容器中存在如下反应:N2(g)+3H2(g)?2NH3(g);△H<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如图关系图:下列叙述正确的是( )| A、图Ⅰ研究的是温度对反应的影响,且甲的温度比乙高 |
| B、图Ⅱ研究的是温度对反应的影响,且甲的温度比乙高 |
| C、图Ⅱ研究的是压强对反应的影响,且甲的压强比乙大 |
| D、图Ⅲ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率比甲高 |
下列离子方程式正确的是( )
| A、三氯化铁溶液中加入铁Fe3++Fe═2Fe2+ |
| B、氯化镁溶液中加入硝酸银溶液Ag++Cl-═AgCl↓ |
| C、过量氯气通入溴化亚铁溶液中2Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- |
| D、硫化亚铁与盐酸反应 S2-+2H+═H2S↑ |
下列离子方程式正确的是( )
| A、足量氯气通入溴化亚铁溶液中:2Fe2++Cl2═2Cl-+2Fe3+ |
| B、碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
| C、氨水中加入少量氯化铝溶液 Al3++4OH-=AlO2-+2H2O |
| D、H2S通入FeCl3溶液中:H2S+2Fe3+═2Fe2++S↓+2H+ |
实验室中需要配制2mol/L的NaOH溶液950mL,配制时应选用的容量瓶的规格和称量的NaOH的质量分别是
( )
( )
| A、950 m L,76.0 g |
| B、500 m L,80.0 g |
| C、1000 mL,80.0 g |
| D、1000 m L,76.0g |
电负性的大小也可以作为判断金属性和非金属性强弱的尺度,下列关于元素电负性的变化规律正确的是( )
| A、周期表中从左到右,主族元素的电负性逐渐变大 |
| B、周期表中从上到下,同一主族元素的电负性逐渐变大 |
| C、电负性越大,金属性越强 |
| D、电负性越小,非金属性越强 |
下列关于电解精炼铜的叙述中不正确的是( )
| A、粗铜板为阳极 |
| B、粗铜所含Au、Ag、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥 |
| C、电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e-=Cu |
| D、精铜的纯度可达99.95%~99.98% |