题目内容
电负性的大小也可以作为判断金属性和非金属性强弱的尺度,下列关于元素电负性的变化规律正确的是( )
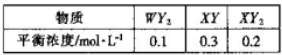
| A、周期表中从左到右,主族元素的电负性逐渐变大 |
| B、周期表中从上到下,同一主族元素的电负性逐渐变大 |
| C、电负性越大,金属性越强 |
| D、电负性越小,非金属性越强 |
考点:元素电离能、电负性的含义及应用
专题:
分析:A、周期表中从左到右非金属性逐渐增强,所以主族元素的电负性逐渐变大;
B、周期表中从上到下,金属性增强,所以同一主族元素的电负性逐渐减小;
C.元素的电负性越小,则元素的非金属性越弱;
D.根据电负性与元素性质的关系分析.
B、周期表中从上到下,金属性增强,所以同一主族元素的电负性逐渐减小;
C.元素的电负性越小,则元素的非金属性越弱;
D.根据电负性与元素性质的关系分析.
解答:
解:A、周期表中从左到右非金属性逐渐增强,所以主族元素的电负性逐渐变大,故A正确;
B、周期表中从上到下,金属性增强,所以同一主族元素的电负性逐渐减小,故B错误;
C.元素电负性越大,原子对键合电子吸引力越大,则元素非金属性越强,故C错误;
D.元素的电负性越大,越易得电子,元素的非金属性越强,元素的电负性越小,则元素的非金属性越弱,故D错误;
故选A.
B、周期表中从上到下,金属性增强,所以同一主族元素的电负性逐渐减小,故B错误;
C.元素电负性越大,原子对键合电子吸引力越大,则元素非金属性越强,故C错误;
D.元素的电负性越大,越易得电子,元素的非金属性越强,元素的电负性越小,则元素的非金属性越弱,故D错误;
故选A.
点评:本题考查了电负性的含义,题目难度不大,注意根据电负性的含义进行剖析.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
下列实验现象与氧化还原反应无关的是( )
| A、点燃酒精灯,灯芯燃烧产生黄色火焰 |
| B、碳与氧化铜共热,黑色固体变成红色 |
| C、往澄清石灰水中吹气,石灰水变混浊 |
| D、稀硫酸中加入锌粒,有无色气泡从溶液中逸出 |
对于某些离子的检验及结论一定正确的是( )
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,一定有Ag+ |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变红,一定有NH4+ |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,不一定有Ba2+ |
1 1 |
2 1 |
3 1 |
| A、氢的五种同位素 |
| B、五种氢元素 |
| C、氢的五种核素 |
| D、氢元素的五种不同粒子 |
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它.CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关的推断中错误的是( )
| A、“另一种反应物”一定具有还原性 |
| B、CuH既可做氧化剂也可做还原剂 |
| C、CuH+Cl2═CuCl+HCl(燃烧) |
| D、CuH+HCl═CuCl+H2↑(常温) |
下列说法正确的是( )
| A、一定条件下可以用H2除去乙烷中混有的乙烯 |
| B、苯和四氯化碳都能萃取溴水中的溴 |
| C、乙醇、乙酸和乙酸乙酯三者的混合液可用分液的方法分离 |
| D、甲烷、乙烯和苯在工业上都可通过石油分馏得到 |