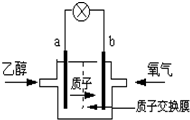
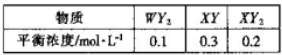
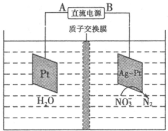
题目内容
下列离子方程式正确的是( )
| A、三氯化铁溶液中加入铁Fe3++Fe═2Fe2+ |
| B、氯化镁溶液中加入硝酸银溶液Ag++Cl-═AgCl↓ |
| C、过量氯气通入溴化亚铁溶液中2Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- |
| D、硫化亚铁与盐酸反应 S2-+2H+═H2S↑ |
考点:离子方程式的书写
专题:
分析:A.电子、电荷不守恒;
B.反应生成氯化银和硝酸镁;
C.溴化亚铁全部被氧化,不符合离子的配比;
D.FeS在离子反应中保留化学式.
B.反应生成氯化银和硝酸镁;
C.溴化亚铁全部被氧化,不符合离子的配比;
D.FeS在离子反应中保留化学式.
解答:
解:A.三氯化铁溶液中加入铁的离子反应为2Fe3++Fe═3Fe2+,故A错误;
B.氯化镁溶液中加入硝酸银溶液的离子反应为Ag++Cl-═AgCl↓,故B正确;
C.过量氯气通入溴化亚铁溶液中的离子反应为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C错误;
D.硫化亚铁与盐酸反应的离子反应为FeS+2H+═H2S↑+Fe2+,故D错误;
故选B.
B.氯化镁溶液中加入硝酸银溶液的离子反应为Ag++Cl-═AgCl↓,故B正确;
C.过量氯气通入溴化亚铁溶液中的离子反应为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C错误;
D.硫化亚铁与盐酸反应的离子反应为FeS+2H+═H2S↑+Fe2+,故D错误;
故选B.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意电子、电荷守恒及离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
用铂作电极电解某种溶液,通电一段时间后,溶液的pH变小,且在阳极得到0.56L气体,阴极得到1.12L气体(两种气体体积均在相同条件下测定).由此可知,该溶液可能是( )
| A、CuSO4溶液 |
| B、HBr溶液 |
| C、NaCl溶液 |
| D、硫酸溶液 |
放热反应CO(g)+H2O(g)?CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol?L-1,其平衡常数为K1.升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
| A、K2和K1的单位均为mol?L-1 |
| B、K2>K1 |
| C、c2(CO)=c2(H2O) |
| D、c1(CO)>c2(CO) |
对于某些离子的检验及结论一定正确的是( )
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,一定有Ag+ |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变红,一定有NH4+ |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,不一定有Ba2+ |
下列有关化学反应速率的说法中,正确的是( )
| A、100 mL 2 mol?L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B、用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C、对于C(s)+H2O(g)?CO(g)+H2(g)的反应,加入固体碳,反应速率加快 |
| D、往容器中再通入O2,可以加快反应2SO2+O2?2SO3的反应速率 |