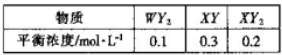
题目内容
下列关于电解精炼铜的叙述中不正确的是( )
| A、粗铜板为阳极 |
| B、粗铜所含Au、Ag、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥 |
| C、电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e-=Cu |
| D、精铜的纯度可达99.95%~99.98% |
考点:铜的电解精炼
专题:
分析:电镀法精炼铜时,粗铜为阳极,精铜为阴极,阳极材料是粗铜,阳极上金属失电子变成离子进入溶液,Cu-2e-=Cu2+,比金属铜活泼的金属锌、铁、镍会先于金属铜失电子,比金属铜活泼性差的Pt、Ag等固体会沉积下来形成阳极泥,这样最终电解铜的纯度可达99.95%~99.98%,根据电解原理来回答.
解答:
解:A、电镀法精炼铜时,粗铜为阳极,精铜为阴极,故A正确;
B、铜中所含Pt、Au、Ag等金属杂质,电解后以单质形式沉积槽底,形成阳极泥,而金属镍、铁、锌都比铜活泼,先于金属铜失电子,故B错误;
C、粗电解时,阳极上只要是金属Cu失电子变成离子进入溶液,Cu-2e-=Cu2+,阳极发生氧化反应,而阴极发生的反应为:Cu2++2e-=Cu,故C正确;
D、根据电解精炼铜的工作原理,这样最终电解铜的纯度可达99.95%~99.98%,故D正确.
故选B.
B、铜中所含Pt、Au、Ag等金属杂质,电解后以单质形式沉积槽底,形成阳极泥,而金属镍、铁、锌都比铜活泼,先于金属铜失电子,故B错误;
C、粗电解时,阳极上只要是金属Cu失电子变成离子进入溶液,Cu-2e-=Cu2+,阳极发生氧化反应,而阴极发生的反应为:Cu2++2e-=Cu,故C正确;
D、根据电解精炼铜的工作原理,这样最终电解铜的纯度可达99.95%~99.98%,故D正确.
故选B.
点评:本题考查学生电解精炼铜的工作原理,可以根据教材知识来回答,注意教材知识的梳理和记忆,难度不大.

练习册系列答案
相关题目
放热反应CO(g)+H2O(g)?CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol?L-1,其平衡常数为K1.升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
| A、K2和K1的单位均为mol?L-1 |
| B、K2>K1 |
| C、c2(CO)=c2(H2O) |
| D、c1(CO)>c2(CO) |
等质量的氯气与下列足量物质反应,转移的电子数最少的是( )
| A、冷的NaOH溶液 |
| B、SO2的水溶液 |
| C、FeCl2溶液 |
| D、铜 |
向某密闭容器中充入1mol CO和2mol H2O(g),发生反应:CO+H2O(g)
CO2+H2.当反应达到平衡时,CO的体积分数为x.若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
| ||
| 高温 |
| A、0.5molCO+2molH2O(g)+1molCO2+1molH2 |
| B、1molCO+1molH2O(g)+1molCO2+1molH2 |
| C、0.5molCO+1.5molH2O(g)+0.4molCO2+0.4 molH2 |
| D、0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2 |
下列有关化学反应速率的说法中,正确的是( )
| A、100 mL 2 mol?L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B、用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C、对于C(s)+H2O(g)?CO(g)+H2(g)的反应,加入固体碳,反应速率加快 |
| D、往容器中再通入O2,可以加快反应2SO2+O2?2SO3的反应速率 |
下列乙醇的化学性质不是由羟基决定的是( )
| A、跟金属钠反应 |
| B、在足量氧气中完全燃烧生成CO2和H2O |
| C、在浓硫酸存在时发生消去反应,生成乙烯 |
| D、当银或铜存在时跟O2发生反应,生成乙醛和水 |