题目内容
 短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p亚层与所有s亚层电子总数相等,D元素原子的L层的p亚层中有3个未成对电子.
短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p亚层与所有s亚层电子总数相等,D元素原子的L层的p亚层中有3个未成对电子.(1)C元素原子基态时的价电子排布式
(2)当n=2时.B的最简单气态氢化物的分子构型为
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s2p2,A、B、C、D四种元素的第一电离能由大到小的顺序为
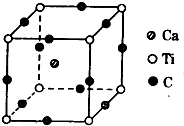
(4)如图为C元素与钛钙元素形成的某晶体结构中的最小重复单元,该晶体中每个钛原子周围与它最近且距离相等的钙离子有
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,则A位于ⅠA族,B元素的原子价电子排布为ns2np2,B位于ⅣA族,C元素位于第二周期且原子中p亚层与s亚层电子总数相等,其原子电子排布式为1s22s22p4,故C为氧元素;D元素原子的L电子层的p亚层中有3个电子,则D元素原子电子排布式为1s22s22p3,故D为N元素,
(1)氧原子核外电子数为8,根据核外电子排布规律书写;
A元素的原子最外层电子排布为ms1,A位于ⅠA族,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键;
(2)当n=2时,B为碳元素,其简单氢化物为CH4,为正四面体结构;根据C原子所成σ键数目,确定杂化方式;CO2为直线型结构,分子中正负电荷中心重合;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体;
(3)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,第一电离能高于O元素,非金属性越强第一电离能越大;
(4)以顶点Ti原子进行研究,该晶体中每个钛原子周围与它最近且距离相等的钙离子位于面心,而每个顶点为8个晶胞共用;根据均摊法计算晶胞中Ca、Ti、O原子数目,进而确定化学式.
(1)氧原子核外电子数为8,根据核外电子排布规律书写;
A元素的原子最外层电子排布为ms1,A位于ⅠA族,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键;
(2)当n=2时,B为碳元素,其简单氢化物为CH4,为正四面体结构;根据C原子所成σ键数目,确定杂化方式;CO2为直线型结构,分子中正负电荷中心重合;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体;
(3)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,第一电离能高于O元素,非金属性越强第一电离能越大;
(4)以顶点Ti原子进行研究,该晶体中每个钛原子周围与它最近且距离相等的钙离子位于面心,而每个顶点为8个晶胞共用;根据均摊法计算晶胞中Ca、Ti、O原子数目,进而确定化学式.
解答:
解:短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,则A位于ⅠA族,B元素的原子价电子排布为ns2np2,B位于ⅣA族,C元素位于第二周期且原子中p亚层与s亚层电子总数相等,其原子电子排布式为1s22s22p4,故C为氧元素;D元素原子的L电子层的p亚层中有3个电子,则D元素原子电子排布式为1s22s22p3,故D为N元素,
(1)C为氧元素,氧原子核外电子数为8,价电子排布为2s22p4;
A元素的原子最外层电子排布为ms1,A位于ⅠA族,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键,属于σ键,
故答案为:2s22p4;σ;
(2)当n=2时,B为碳元素,其简单氢化物为CH4,为正四面体结构;C原子成4个σ键、没有孤对电子,故C原子采取sp3杂化方式;CO2为直线型结构,分子中正负电荷中心重合,属于非极性分子;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体;
故答案为:正四面体;sp3;非极性;原子;
(3)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,N元素原子2p能级容纳3个电子,为半满稳定状态,第一电离能高于O元素,非金属性越强第一电离能越大,故第一电离能N>O>Si>Li,
故答案为:N>O>Si>Li;
(4)以顶点Ti原子进行研究,该晶体中每个钛原子周围与它最近且距离相等的钙离子位于面心,每个顶点为8个晶胞共用,故与Ti原子最近且距离相等的钙离子有8个,晶胞中Ca原子数目=1、Ti原子数目=8×
=1、O原子数目=12×
=4,该晶体的化学式为 CaTiO3,
故答案为:8;CaTiO3.
(1)C为氧元素,氧原子核外电子数为8,价电子排布为2s22p4;
A元素的原子最外层电子排布为ms1,A位于ⅠA族,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键,属于σ键,
故答案为:2s22p4;σ;
(2)当n=2时,B为碳元素,其简单氢化物为CH4,为正四面体结构;C原子成4个σ键、没有孤对电子,故C原子采取sp3杂化方式;CO2为直线型结构,分子中正负电荷中心重合,属于非极性分子;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体;
故答案为:正四面体;sp3;非极性;原子;
(3)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,N元素原子2p能级容纳3个电子,为半满稳定状态,第一电离能高于O元素,非金属性越强第一电离能越大,故第一电离能N>O>Si>Li,
故答案为:N>O>Si>Li;
(4)以顶点Ti原子进行研究,该晶体中每个钛原子周围与它最近且距离相等的钙离子位于面心,每个顶点为8个晶胞共用,故与Ti原子最近且距离相等的钙离子有8个,晶胞中Ca原子数目=1、Ti原子数目=8×
| 1 |
| 8 |
| 1 |
| 3 |
故答案为:8;CaTiO3.
点评:本题考查结构性质位置关系、核外电子排布、分子结构与性质、杂化轨道、电离能、晶胞计算等,难度中等,注意基础知识的理解掌握.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
NA为阿伏伽德罗常数,下列说法正确的是( )
| A、标准状况下,22.4L CO2与CO的混合气体中含有3NA个氧原子 |
| B、0.1mol/L的Na2CO3溶液中含有OH-数小于0.1NA |
| C、1mol乙醇中所含有的共用电子对数目比44g乙醛多2NA |
| D、足量的锌与一定量的浓硫酸反应生成1mol气体时,转移的电子数为2NA |
某同学设计了以下几个实验方案,其中可行的为( )
A、已知质量的铝镁合金,通过下面实验设计可以测定镁的质量分数:铝镁合金
| ||
| B、在配制一定物质的量浓度的溶液时,先称量或量取物质,再溶解或稀释,并将溶液转移至容量瓶,洗涤烧杯和玻璃棒并将洗涤液转移到容量瓶,继续往容量瓶中加水至溶液的凹液面正好与刻度线相切 | ||
| C、用裂化汽油萃取溴水中的溴之后进行分液时,水层从分液漏斗的下口放出 | ||
| D、欲检验SO2中是否混有CO2,可将该气体依次通过盛有饱和碳酸氢钠溶液、品红溶液、澄清石灰水的洗气瓶,若品红溶液不褪色且澄清石灰水变浑浊,则证明混有CO2 |
下列有关做法正确的是( )
| A、将水沿烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌 |
| B、实验室制取氯气时,尾气用碱液吸收 |
| C、金属钠、镁着火时,可用泡沫灭火器来灭火 |
| D、夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏的原因,然后打开所有的门窗通风 |
 叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为: 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题. A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质.
A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质. 氧化还原反应规律是化学学科的重要规律之一.按要求回答下列问题:
氧化还原反应规律是化学学科的重要规律之一.按要求回答下列问题: