题目内容
下列有关能量的判断或表示方法正确的是( )
| A、从C(石墨)=C(金刚石)△H=1.9 kJ?mol-1,可知金刚石比石墨更稳定 |
| B、等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| C、由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1,则向含0.1 mol HCl的盐酸中加入4.0gNaOH固体,放出热量等于5.73 kJ |
| D、同一个化学反应,化学计量数不同,△H的值不同;化学计量数相同而状态不同,△H的值也不同 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、物质所含能量越低越稳定;
B、S固体转化为硫蒸气的过程是吸热过程,硫的燃烧过程是放热过程;
C、NaOH固体溶于水放热;
D、△H与化学计量数、物质的状态有关.
B、S固体转化为硫蒸气的过程是吸热过程,硫的燃烧过程是放热过程;
C、NaOH固体溶于水放热;
D、△H与化学计量数、物质的状态有关.
解答:
解:A、从C(石墨)=C(金刚石)△H=1.9 kJ?mol-1,可知:石墨具有的能量较低,物质具有的能量越低越稳定,所以石墨比金刚石更稳定,故A错误;
B、硫固体转化为硫蒸气的过程是吸热过程,硫蒸气和硫固体分别完全燃烧,硫蒸气放出热量更多,故B错误;
C、氢氧化钠固体溶于水放热,向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量大于5.73 kJ,故C错误;
D、△H的值与化学计量数对应,与物质的状态有关,故D正确.
故选D.
B、硫固体转化为硫蒸气的过程是吸热过程,硫蒸气和硫固体分别完全燃烧,硫蒸气放出热量更多,故B错误;
C、氢氧化钠固体溶于水放热,向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量大于5.73 kJ,故C错误;
D、△H的值与化学计量数对应,与物质的状态有关,故D正确.
故选D.
点评:本题考查学生化学反应的反应热和焓变间的关系知识,注意中和热的测定实验中使用的是强酸和强碱的稀溶液,注意物质稳定性与能量的关系,难度不大.

练习册系列答案
相关题目
实验过程中,不会产生气体的( )
A、 |
B、 |
C、 |
D、 |
A、B、C为三种短周期元素.A、B同周期,A、C的最低价离子分别为A2-、C-离子,且半径A2->C-,B2+与C-具有相同的电子层结构.下列说法不正确的是( )
| A、原子序数 A>B>C |
| B、离子半径 A2->C->B2+ |
| C、原子半径 C>B>A |
| D、最外层电子数 C>A>B |
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,16gCH4中含有5NA个原子 |
| B、1molNa和足量的O2在加热条件下充分反应,转移的电子数为2NA |
| C、1mol/L的Na2CO3溶液中含有2NA个Na+ |
| D、标准状况下,22.4L己烷的分子数为NA |
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、3molNO2气体溶于足量水中充分反应转移的电子总数为2NA |
| B、7.8g Na2O2固体中含有的离子总数为0.4NA |
| C、标准状况下,11.2L的SO3与足量水充分反应生成的溶液中H+的总数为NA |
| D、0.5molNa在适量的氧气中燃烧生成Na2O2和Na2O,得到的电子总数为0.5NA |
下列实验最终能看到白色沉淀的是( )
| A、CO2和SO2气体通入CaCl2溶液 |
| B、过量SO3通入Ba(OH)2溶液 |
| C、过量CO2通入Ba(OH)2溶液 |
| D、过量CO2通入澄清的石灰水 |
如图所示的电化学装置,下列叙述正确的是( )
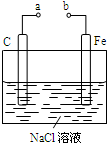

| A、a和b用导线连接,电子由碳经过导线流向铁 |
| B、a和b用导线连接,铁电极的电极反应为:Fe-3e-=Fe3+ |
| C、a、b分别连接直流电源正、负极,可以防止铁被腐蚀 |
| D、a、b分别连接直流电源负、正极,电压足够大时,Na+向铁电极移动 |
人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图.下列有关说法正确的是( )

| A、a为电源的负极 |
| B、电解结束后,阴极室溶液的pH与电解前相比将升高 |
| C、阳极室中发生的电极反应为2H++2e-=H2↑ |
| D、若两极共收集到气体13.44L(标准状况),则除去的尿素为7.2g(忽略气体的溶解) |
羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.下列有关说法正确的是( )
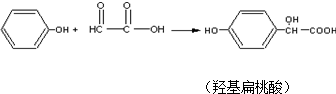

| A、苯酚和羟基扁桃酸互为同系物 |
| B、标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24 NA |
| C、乙醛酸只存在一种不同环境的氢原子 |
| D、羟基扁桃酸分子中至少有12个原子共平面. |