题目内容
7.在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH2O(g)的混合气体,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:| 0min | 10min | 20min | 30min | 40min | 50min | |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
(2)1100℃时化学平衡常数K=$\frac{4}{9}$,该反应为放热反应(填“吸热”和“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡向正反应方向移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量不变(选填“增大”或“减小”或“不变”).
分析 (1)根据v=$\frac{\frac{△n}{V}}{△t}$计算v(CO),再根据速率之比等于化学计量数之比计算v(CO2);
830℃时40min到达平衡,平衡时转化的CO为1mol-0.5mol=0.5mol,进而计算平衡后CO转化率;
(2)由表中数据可知,1100℃时20min时反应到达平衡,计算平衡时各组分的物质的量浓度,代入平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算;
升高温度,平衡时CO物质的量增大,说明升高温度平衡逆向移动;
(3)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,注意选择判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化,说明反应到达平衡;
(4)增大反应物浓度,平衡向正反应方向移动,可以等效为增大压强,该反应是一个反应前后气体体积不变的可逆反应,压强不影响平衡移动.
解答 解:(1)1100℃时,前10minv(CO)=$\frac{\frac{1mol-0.75mol}{1L}}{10min}$=0.025mol/(L.min),速率之比等于化学计量数之比,则v(CO2)=v(CO)=0.025mol/(L.min),
830℃时40min到达平衡,平衡时转化的CO为1mol-0.5mol=0.5mol,平衡后CO转化率为$\frac{0.5mol}{1mol}$×100%=50%,
故答案为:0.025mol/(L.min);50%;
(2)由表中数据可知,20min时反应到达平衡,反应达到平衡状态时,c(CO)=$\frac{0.6mol}{1L}$=0.6mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L):1 1 0 0
变化(mol/L):0.4 0.4 0.4 0.4
平衡(mol/L):0.6 0.6 0.4 0.4
故平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.4×0.4}{0.6×0.6}$=$\frac{4}{9}$,
升高温度,平衡时CO物质的量增大,说明升高温度平衡逆向移动,则正反应为放热反应,
故答案为:$\frac{4}{9}$;放热;
(3)(a)该反应是反应前后气体体积不变的化学反应,所以无论反应是否达到平衡状态,容器中压强始终不变,所以不能据此判断平衡状态,故错误;
(b)反应达到平衡状态时,反应体系中各物质的物质的量浓度不变,混合气体中c(CO)不变,说明反应到达平衡,故正确;
(c)v逆(H2)=v正(H2O)时,则水的生成速率等于其消耗速率,反应达到平衡状态,故正确;
(d)无论反应是否达到平衡状态,c(CO2)与c(CO)都有可能相等,与反应初始浓度和转化率有关,不能作为判断平衡状态的依据,故错误;
故选:bc;
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),反应物浓度增大平衡向正反应方向移动,可以等效为增大压强,该反应是一个反应前后气体体积不变的可逆反应,压强不影响平衡移动,所以再达到平衡时,H2百分含量不变,
故答案为:向正反应方向;不变.
点评 本题考查反应速率的计算、平衡常数的计算、平衡状态的判断、化学平衡移动等知识点,难度不大,注意平衡状态的判断中只有随反应进行发生变化的物理量才能作为判断平衡状态的依据.

| A. | 1mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | Na+、OH-、Fe2+、S2- | |
| C. | 碱性溶液:Na+、SO42-、AlO2-、SO32- | |
| D. | 酸性溶液中:MnO4-、I-、Na+、Al3+ |
| 碱 | A | B | C |
| 化学式(X、Y为未知元素) | XOH | KOH | Y(OH)2 |
| 摩尔质量之比 | A:C=20:37 | ||
(1)45.28g混合碱所含A、C的质量分别为14.8g、14.8g.
(2)A与C的摩尔质量分别是40g/mol、74g/mol.
| A. | CO2的水溶液:c(H+)>c(HCO3-)>2c(CO32-) | |
| B. | 等浓度的HCN溶液与Na0H溶液等体积混合,所得溶液pH>7,则溶液中离子浓度:c(Na+)>c(CN-)>c(OH-)>c(H+) | |
| C. | 0.4mol•L-1某一元酸HA溶液和0.2mol•L-1Na0H溶液等体积混合的溶液中:2c(OH-)+c(A-)=2c(H+)+c(HA) | |
| D. | 两种弱酸HX和HY混合后,溶液中的c(H+)为(Ka为电离平衡常数):c(H+)=$\frac{{K}_{a}(HX)•c(HX)}{c({X}^{-})}$+$\frac{{K}_{a}(HY)•c(HY)}{c({Y}^{-})}$+c(OH-) |
| A. | 15mol、25% | B. | 20mol、75% | C. | 20mol、50% | D. | 40mol、80% |
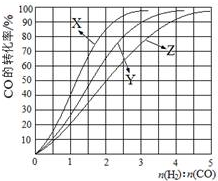
(1)经研究发现在230℃~270℃时合成最为有利.为探寻合成气最合适的起始组成比,分别在230℃、250℃和270℃时进行实验,实验结果如图.230℃的实验结果所对应的曲线是X(填字母); 从提高CO转化率的角度等综合分析,该温度下工业生产适宜采用的合成气组成n(H2):n(CO)的比值范围是B(填字母).
A.1~1.5 B.2.5~3C.3.5~4.5
(2)制甲醇所需要的氢气,可通过下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),△H<0,某温度下该反应的平衡常数K=1.回答下列问题:
①该温度下,若起始时c(CO)=2mol•L-1,c(H2O)=3mol•L-1,反应进行一段时间后,测得CO的浓度为1mol•L-1,则此时该反应v(正)>v(逆)(填“>”、“<”或“=”).
②若降低温度,该反应的K值将增大(填“增大”、“减小”或“不变”).
(3)甲醇是一种化工原料,工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
②变化的热量数值Q中,Q1 与Q2的和是90.8(填具体数值).
(4)目前,以甲醇为原料的燃料电池已经应用于工业生产.如图是甲醇燃料电池应用的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,
 ,
,请根据上图填写下列空白:
乙池中A电极的电极反应式为Ag++e-=Ag,甲池中通入CH3OH电极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
| A. | 1 mol CH3+(碳正离子)中含有质子数为8NA | |
| B. | 标准状况下,22.4 L溴单质所含原子数目为2NA | |
| C. | 常温下,100mLlmol.L-l盐酸与4.6 g钠反应生成H2分子数目为0.1 NA | |
| D. | 密闭容器盛有0.1 mol N2和0.3 mol H2在一定条件下充分反应,转移电子的数目为0.6 NA |
| A. | 中和pH和体积均相同的盐酸和醋酸溶液,消耗相同浓度的NaOH的体积较多的是醋酸 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液蒸干、灼烧都得到Fe2O3 | |
| C. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
 在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为不对称碳原子(或手性碳原子).具有手性碳原子的有机物具有光学活性.八角属于草本植物,主要产于中国和越南,是我国民间常用做烹调的香料.最新医学研究成果显示,从八角中可以提取到莽草酸,它是一种白色晶体,微溶于水,是制取抗禽流感药的基本原料.莽草酸的结构式如图:
在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为不对称碳原子(或手性碳原子).具有手性碳原子的有机物具有光学活性.八角属于草本植物,主要产于中国和越南,是我国民间常用做烹调的香料.最新医学研究成果显示,从八角中可以提取到莽草酸,它是一种白色晶体,微溶于水,是制取抗禽流感药的基本原料.莽草酸的结构式如图: $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.