题目内容
17.下列叙述正确的是( )| A. | 中和pH和体积均相同的盐酸和醋酸溶液,消耗相同浓度的NaOH的体积较多的是醋酸 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液蒸干、灼烧都得到Fe2O3 | |
| C. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
分析 A、pH相同的盐酸和醋酸溶液,醋酸的浓度大;
B、FeCl3溶液水解得到挥发性酸,Fe2(SO4)3溶液水解得到的是非挥发性的酸;
C、根据铵根离子对氢氧化镁的沉淀溶解平衡的影响来回答;
D、向0.1mol/L的氨水中加入少量硫酸铵固体,溶液中铵根离子浓度增大,抑制了一水合氨的电离.
解答 解:A、中和pH与体积均相同的盐酸和醋酸溶液,醋酸的浓度大,则消耗的NaOH的物质的量多,故A正确;
B、FeCl3溶液和蒸干、灼烧都得到Fe2O3,Fe2(SO4)3溶液蒸干、灼烧得到Fe2(SO4)3,故B错误;
C、在Mg(OH)2的悬浊液中加入氯化铵溶液,铵根离子结合氢氧根离子,促进氢氧化镁溶解,溶液c(Mg2+)增大,故C错误;
D、向0.1mol/L的氨水中加入少量硫酸铵固体,溶液中铵根离子浓度增大,抑制了一水合氨的电离,则一水合氨的浓度增大,氢氧根离子的浓度减小,则溶液中氢氧根离子和一水合氨的浓度比值减小,故D错误.
故选A.
点评 本题考查盐的水解原理、弱电解质的电离等知识,题目难度中等,注意知识的迁移应用是关键,难度中等.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
7.在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH2O(g)的混合气体,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
(1)1100℃时,前10min该反应的化学反应速率v(CO2)=0.025mol/(L.min),830℃平衡后CO转化率的为50%.
(2)1100℃时化学平衡常数K=$\frac{4}{9}$,该反应为放热反应(填“吸热”和“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡向正反应方向移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量不变(选填“增大”或“减小”或“不变”).
| 0min | 10min | 20min | 30min | 40min | 50min | |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
(2)1100℃时化学平衡常数K=$\frac{4}{9}$,该反应为放热反应(填“吸热”和“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡向正反应方向移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量不变(选填“增大”或“减小”或“不变”).
8.工业上常用氯气给自来水消毒.某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是( )
| A. | AlCl3 | B. | NaOH | C. | NaHCO3 | D. | AgNO3 |
5.下列说法或结论正确的是( )
| A. | 等物质的量C3H8与C3H8O完全燃烧时耗氧量相同 | |
| B. | 某气态有机物的密度为ρ,其相对分子质量为22.4ρ | |
| C. | 硬脂酸常温下呈固态,难溶于水,酸性比醋酸弱 | |
| D. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 |
2.下列装置、试剂选用或操作正确的是( )
| A. | 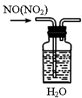 除去NO中的NO2 | B. | 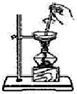 用于AlCl3蒸发结晶 | ||
| C. | 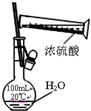 稀释浓硫酸 | D. |  制备少量O2 |