题目内容
8.为测定硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O晶体纯度,某学生取mg硫酸亚铁铵样品配置成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:(甲)方案一:取20.00mL硫酸亚铁铵溶液于锥形瓶,用0.1000mol•L-1的酸性KMnO4溶液进行滴定.
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如下实验.
待测液$\stackrel{足量的BaCl_{2}溶液}{→}$$\stackrel{过滤}{→}$$\stackrel{洗涤}{→}$$\stackrel{干燥}{→}$$\stackrel{稳重}{→}$Wg固体
(1)方案一的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;判断达到滴定终点的依据是当最后一滴酸性高锰酸钾标准溶液滴入时,锥形瓶内溶液由黄色变为浅紫色,且半分钟内不再恢复原色,说明达到滴定终点;
(2)方案二的离子方程式为SO42-+Ba2+=BaSO4↓;若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为Fe2+已被空气部分氧化,如何验证你的假设取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化.
(丙)方案三:(通过NH4+测定)实验设计图如下所示.取20.00mL硫酸亚铁铵溶液进行该实验.
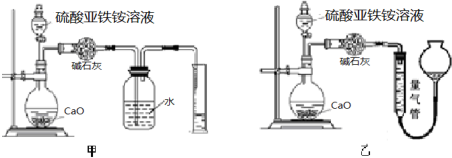
(3)①装置乙(填“甲”或“乙”)较为合理,判断理由是氨气极易溶于水,图一装置无法排液体,甚至会出现倒吸.量气管中最佳试剂是c(填字母编号.如选“乙”则填此空,如选“甲”此空可不填).
A.水 B.饱和NaHCO3溶液 C.CCl4
②选用该装置会导致测量值总是偏大一些,分析原因装置内的空气被量出导致测量值偏大.
③若测得NH3的体积为VL(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为$\frac{392V×500}{2×22.4m×20}$×100%(列出计算式即可,不用简化).
分析 (1)取20.00mL硫酸亚铁铵溶液于锥形瓶,用0.1000mol•L-1的酸性KMnO4溶液进行滴定发生反应为高锰酸钾溶液氧化亚铁离子为铁离子,结合电荷守恒和原子守恒书写离子方程式,利用高锰酸钾溶液的颜色变化判断反应终点;
(2)取20.00mL硫酸亚铁铵溶液加入氯化钡溶液生成硫酸钡沉淀,测定沉淀质量计算,亚铁离子具有还原性,易被氧化;检验亚铁离子的氧化产物铁离子;
(3)①根据氨气的溶解性和装置特点分析;
②选用该装置会导致测量值总是偏大一些,是因为装置内空气也被量到气体的体积中;
③根据氨气的体积计算氨气的物质的量,根据N守恒计算出硫酸亚铁铵的质量,进而计算质量分数.
解答 解:(1)酸性KMnO4溶液进行滴定发生反应时高锰酸钾溶液氧化亚铁离子为铁离子,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,判断达到滴定终点的依据是当最后一滴酸性高锰酸钾标准溶液滴入时,锥形瓶内溶液由黄色变为浅紫色,且半分钟内不再恢复原色,说明达到滴定终点,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;当最后一滴酸性高锰酸钾标准溶液滴入时,锥形瓶内溶液由黄色变为浅紫色,且半分钟内不再恢复原色,说明达到滴定终点;
(2)取20.00mL硫酸亚铁铵溶液加入氯化钡溶液生成硫酸钡沉淀,反应的离子方程式为:SO42-+Ba2+=BaSO4↓,亚铁离子具有还原性,易被氧化成铁离子,故测得硫酸亚铁铵浓度偏小;可检验亚铁离子的氧化产物铁离子,具体操作为:取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
故答案为:SO42-+Ba2+=BaSO4↓;Fe2+已被空气部分氧化;取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
(3)①氨气易溶于水,不能用排水法收集,甲装置中导管伸入液面下,易倒吸,用排水法,不合理;乙装置中导管在液面以上,符合排液体收集气体要求,量气管中液体应不能溶解氨气,氨气易溶于水和饱和碳酸钠溶液,难溶于四氯化碳,故用排四氯化碳法收集;
故答案为:乙;氨气极易溶于水,图一装置无法排液体,甚至会出现倒吸;c;
②选用乙装置会导致测量值总是偏大一些,原因是装置中的空气体积也被量气管量到生成气体的体积中,使测定结果偏大,
故答案为:装置内的空气被量出导致测量值偏大;
③VL氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,m g硫酸亚铁铵样品中含N的物质的量为$\frac{500ml}{20ml}$×$\frac{V}{22.4}$mol=$\frac{25V}{22.4}$mol,
硫酸亚铁铵的纯度为:$\frac{\frac{25V}{22.4}mol×\frac{1}{2}×392g/mol}{mg}$×100%=$\frac{392V×500}{2×22.4m×20}$×100%,
故答案为:$\frac{392V×500}{2×22.4m×20}$×100%.
点评 本题考查制备实验方案的设计、物质性质、装置图的理解应用,综合性较强,注意结合题给信息和装置特点及物质的性质分析,题目难度中等.

 快捷英语周周练系列答案
快捷英语周周练系列答案| A. | 盐酸能导电,所以盐酸是电解质 | |
| B. | 纯碱的化学式:NaOH | |
| C. | 碳酸钾的电离方程式:K2CO3=2K+1+CO3-2 | |
| D. | 氯离子的结构示意图为: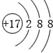 |
| A. | 与AlCl3溶液发生反应的离子方程式为Al3++3OH-═Al(OH)3↓ | |
| B. | 加水稀释,氨水的电离平衡向逆反应方向移动 | |
| C. | 用HNO3溶液恰好完全中和,中和后溶液不显中性 | |
| D. | 其溶液的pH=13 |
| A. | 不同的核素一定是不同的原子 | |
| B. | H2和D2互为同位素 | |
| C. | 所有主族元素的最高正化合价都等于其价电子数 | |
| D. | 所有的过渡元素都是金属元素,所有的金属元素也都是过渡元素 |
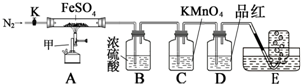 硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.
硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.实验步骤:
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取m gFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K.加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的气体,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃.待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末.请回答下列问题:
(1)仪器甲的名称是酒精喷灯;
(2)B中浓硫酸的作用吸收分解产生的SO3;
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化.写出C中发生反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)FeSO4完全分解后,还需要通入一段时间N2的原因是将装置内残留的气体排入吸收装置2完全吸收,同时防止发生倒吸;
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
I、称量B装置在实验前后增重0.80g;
II、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
III、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mol/L标准H2C2O4溶液滴定至终点;
IV、重复实验3次,记录数据如表
| 实验 | 滴定管开始读数 | 滴定终点读数 |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
②FeSO4分解的化学方程式为8FeSO4 $\frac{\underline{\;高温\;}}{\;}$4Fe2O3+2SO3↑+6SO2↑+O2↑;
(6)请设计一个实验来检验A中的FeSO4是否完全分解将废液后的固体转移到小烧杯中,加入少量水搅拌过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明硫酸亚铁未全部分解,反之则分解完全.

| A. | 溶液中OH-向石墨极移动 | |
| B. | A1电极附近溶液的pH保持不变 | |
| C. | 石墨极的电极反应式为MnO4-+3e-+4H═MnO2+2H2O | |
| D. | KMnO4中锰元素价态高,因此在同条件下放电容量比MnO2的大 |



 或
或 ;
; .
. 某化学实验小组选用图所示装置和下列所给试剂来证明非金属性:Cl>I.
某化学实验小组选用图所示装置和下列所给试剂来证明非金属性:Cl>I.