题目内容
19.已知有如下转化关系(其中有关条件已省略):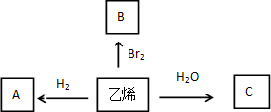
则:(1)写出A和B的结构简式:A、CH3CH3;B、CH2BrCH2Br.
(2)写出乙烯生成C的化学方程式:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH.
(3)写出C的一种同分异构体的结构简式CH3OCH3.
分析 由图可知,乙烯和氢气反应生成A为CH3CH3,乙烯和溴水反应生成B,B应为CH2BrCH2Br,C是乙烯与水加成后的产物,则C为CH3CH2OH,然后结合物质的性质及题目要求来解答.
解答 解:由图可知,乙烯和氢气反应生成A为CH3CH3,乙烯和溴水反应生成B,B应为CH2BrCH2Br,C是乙烯与水加成后的产物,则C为CH3CH2OH,
(1)由以上分析可知A为CH3CH3,B为,故答案为:CH3CH3;CH2BrCH2Br;
(2)乙烯和水在一定条件下发生加成反应生成乙醇,方程式为CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH,故答案为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH;
(3)C为CH3CH2OH,同分异构体为CH3OCH3,故答案为:CH3OCH3.
点评 本题考查有机物的推断,为高频考点,侧重常见有机物性质及反应的考查,注意反应中官能团的变化,题目难度不大.

练习册系列答案
相关题目
9.下列关于乙醇的说法不正确的是( )
| A. | 可用粮食发酵制取 | B. | 可由乙烯通过加成反应制取 | ||
| C. | 与乙醛互为同分异构体 | D. | 通过取代反应可以制取乙酸乙酯 |
10.下列微粒半径由大到小的排列是( )
| A. | P3-、S2-、Cl- | B. | Cl-、S2-、O2- | C. | Ca、Mg、Na | D. | K+、Cl-、S2- |
7.能证明乙醇分子中含有一个羟基的事实是( )
| A. | 1mol乙醇完全燃烧生成3mol水 | |
| B. | 乙醇能与水以任意比例互溶 | |
| C. | 乙醇沸点较高 | |
| D. | 0.1mol乙醇与足量金属钠反应生成0.05molH2 |
14.将澄清的自来水制成蒸馏水,最好的方法是( )
| A. | 过滤 | B. | 蒸馏 | C. | 蒸发 | D. | 萃取 |
11.下列化学药品的贮存方法正确的是( )
| A. | 浓硝酸存放在带玻璃塞的无色细口瓶中 | |
| B. | 少量碘储存在酒精中 | |
| C. | 氢氧化钠固体保存在磨口玻璃塞的试剂瓶中 | |
| D. | 少量金属钠保存在煤油中 |
9.国际纯粹与应用化学联合会已确定第118号元素为Uuo.关于${\;}_{118}^{297}Uuo$的判断错误的是( )
| A. | Uuo的原子序数为118 | B. | ${\;}_{118}^{297}Uuo$的核内中子数为179 | ||
| C. | ${\;}_{118}^{297}Uuo$的核外电子数为118 | D. | Uuo的相对原子质量为297 |