题目内容
17.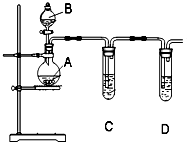 某化学实验小组选用图所示装置和下列所给试剂来证明非金属性:Cl>I.
某化学实验小组选用图所示装置和下列所给试剂来证明非金属性:Cl>I.请你按照他们的设计思路完成该实验.
【可供选择的试剂有】
①稀盐酸,②浓硫酸,③MnO2,④浓盐酸,⑤淀粉碘化钾溶液,⑥KMnO4,⑦NaOH溶液,⑧硝酸银溶液.
烧瓶A中应盛放的药品是⑥(填序号),试管C中应盛放的药品是⑤(填序号),则装置D的作用是吸收未反应完的氯气,防止污染环境,当观察到现象C中溶液变蓝,即可证明非金属性Cl>I.
分析 KMnO4与浓盐酸反应生成氯气,氯气具有强氧化性,能将碘离子氧化为碘单质,碘遇淀粉试液变蓝色,由此分析解答.
解答 解:KMnO4与浓盐酸反应生成氯气,氯气与淀粉碘化钾混合溶液反应生成碘单质,碘遇淀粉试液变蓝色,故C中溶液变为蓝色,
氯气与淀粉碘化钾混合溶液反应离子方程式为:Cl2+2I-═2Cl-+I2,则证明了非金属性:Cl>I,所以烧瓶A中应盛放的药品是
KMnO4,管C中应盛放的药品是粉碘化钾溶液,则装置D的作用是用氢氧化钠吸收多余的氯气,当观察到现象溶液变为蓝色可证明非金属性Cl>I,
故答案为:⑥;⑤;吸收未反应完的氯气,防止污染环境;C中溶液变蓝.
点评 本题考查实验方案设计,涉及非金属性强弱的比较等,明确物质的性质是解本题关键,同时考查学生灵活运用知识解答问题的能力,题目难度不大.

练习册系列答案
相关题目
7.能证明乙醇分子中含有一个羟基的事实是( )
| A. | 1mol乙醇完全燃烧生成3mol水 | |
| B. | 乙醇能与水以任意比例互溶 | |
| C. | 乙醇沸点较高 | |
| D. | 0.1mol乙醇与足量金属钠反应生成0.05molH2 |
5.我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金…其水甚强,五金八石皆能穿第,惟玻璃可盛”.下列关于“强水”的判断错误的是( )
| A. | “强水”可能是重水 | B. | “强水”可能是硝酸 | ||
| C. | “强水”可能具有强氧化性、强酸性 | D. | “强水”不可能是氢氧化钠溶液 |
12.某溶液中可能含有下列5种离子中的某几种:SO42-、CO32-、NH4+、Na+、Cl-.为确认溶液组成进行如下实验:
(1)向100mL上述溶液中加入足量BaCl2溶液,反应后将浊液过滤、洗涤、干燥,得沉淀2.33g,向沉淀中加入过量的盐酸,过滤、洗涤、干燥,得沉淀2.33g.
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体560mL(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
(1)向100mL上述溶液中加入足量BaCl2溶液,反应后将浊液过滤、洗涤、干燥,得沉淀2.33g,向沉淀中加入过量的盐酸,过滤、洗涤、干燥,得沉淀2.33g.
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体560mL(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
| A. | 一定存在SO42-、NH4+、Cl-,一定不存在CO32- | |
| B. | c(SO42-)=0.1mol•L-1,c(Cl-)>c(SO42-) | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在Na+ | |
| D. | 一定存在SO42-、NH4+,可能存在Na+、Cl- |
2.下列化学用语中,正确的是( )
| A. | 乙烯的结构简式CH2CH2 | B. | NaCl的电子式  | ||
| C. | CO2分子的结构式O-C-O | D. | Mg原子结构示意图  |
9.国际纯粹与应用化学联合会已确定第118号元素为Uuo.关于${\;}_{118}^{297}Uuo$的判断错误的是( )
| A. | Uuo的原子序数为118 | B. | ${\;}_{118}^{297}Uuo$的核内中子数为179 | ||
| C. | ${\;}_{118}^{297}Uuo$的核外电子数为118 | D. | Uuo的相对原子质量为297 |
6.等质量的两种烃完全燃烧,生成CO2及消耗O2的量均相同,则这两种烃( )
| A. | 实验式一定相同 | B. | 一定是同系物,有相同的通式 | ||
| C. | 只能是同种物质 | D. | 一定互为同分异构体 |