题目内容
18.已知某溶液中存在OH-、H+、Cl-、NH4+四种离子,其离子浓度大小有如下关系:①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)=c(H+)>c(Cl-)>c(OH-)
③c(NH4+)=c(Cl-)且c(H+)=c(OH-)
④c(OH-)>c(H+)>c(Cl-)>c(NH4+)
⑤c(Cl-)>c(H+)>c(NH4+)>c(OH-),
其中可能正确的是( )
| A. | ①④ | B. | ②⑤ | C. | ③④ | D. | ①③⑤ |
分析 溶液中存OH-、H+、NH4+和C1-四种离子,溶液中溶质可以有以下三种情况:NH4Cl;NH4Cl和NH3?H2O;NH4Cl和HCl,任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答 解:溶液中存OH-、H+、NH4+和C1-四种离子,溶液中溶质可以有以下三种情况:NH4Cl;NH4Cl和NH3?H2O;NH4Cl和HCl,任何电解质溶液中都存在电荷守恒和物料守恒,
①如果溶液中溶质为氯化铵,铵根离子水解导致溶液呈酸性,则c(H+)>c(OH-),但水解程度较小,结合电荷守恒得c(Cl-)>c(NH4+),所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故正确;
②任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以不能存在c(NH4+)=c(H+)>c(Cl-)>c(OH-),故错误;
③如果溶液中溶质为氯化铵和一水合氨,溶液呈中性,则存在c(H+)=c(OH-),结合电荷守恒得c(NH4+)=c(Cl-),所以存在c(NH4+)=c(Cl-)且c(H+)=c(OH-),故正确;
④任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以不能存在c(OH-)>c(H+)>c(Cl-)>c(NH4+),故错误;
⑤如果溶液中溶质为HCl和NH4Cl,且酸浓度远远大于氯化铵浓度,则可能存在c(Cl-)>c(H+)>c(NH4+)>c(OH-),故正确;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意守恒思想的灵活运用,题目难度不大.

练习册系列答案
相关题目
9.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. |  配制溶液 | B. |  分离乙醇和水 | ||
| C. |  除去CO气体中的CO2 | D. |  除去粗盐中的不溶物 |
6.用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
| A. | 干燥的 | B. | 以上三项均须要求的 | ||
| C. | 用欲配制的溶液润洗过的 | D. | 瓶塞不漏水的 |
13.如图是某加碘食盐包装袋上的部分图表文字.由此你得到的信息和作出的推测是( )
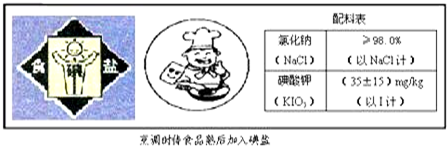

| A. | 可以用酒精从该碘盐配制的溶液中萃取KIO3 | |
| B. | “烹调时待食品熟后加入碘盐”的原因可能是碘酸钾受热易分解 | |
| C. | 1 kg此食盐中含碘酸钾(35±15)mg | |
| D. | 食用加碘盐的目的是预防龋齿 |
3.${\;}_{92}^{235}U$是重要的工业原料,下列说法不正确的是( )
| A. | ${\;}_{92}^{235}U$原子核中含有92个质子 | B. | ${\;}_{92}^{235}U$原子核外有92个电子 | ||
| C. | ${\;}_{92}^{235}U$与${\;}_{92}^{238}U$互称为核素 | D. | ${\;}_{92}^{235}U$与${\;}_{92}^{238}U$中子数不同 |
10.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 向某未知溶液中滴加几滴稀溴水 | 没有生成白色沉淀 | 溶液中一定不含苯酚 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | 分别加热Na2CO3和NaHCO3固体 试管内壁都有水珠 两种物质均受热分解 | |
| B. | 向某未知溶液中滴加几滴稀溴水 没有生成白色沉淀 溶液中一定不含苯酚 | |
| C. | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 加入淀粉后溶液变成蓝色 氧化性:Cl2>I2 | |
| D. | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 加入H2O2后溶液变成血红色 Fe2+既有氧化性又有还原性 |
8.比较是化学学习中的一种重要方法.下列各组比较中不正确的是( )
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 热稳定性:HF>HCl>HBr>HI | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸钠溶液与稀盐酸互滴时,两种操作现象相同 |