题目内容
1.氮及其化合物在生产、生活中有重要的应用.回答下列问题:(1)下列选项可作为比较氮和氧非金属性强弱的判断依据的是ac.
a.氢化物稳定性:H2O>NH3 b.沸点:H2O>NH3
c.一定条件下,O2能将NH3氧化 d.碱性:NH3>H2O
(2)氢氰酸(HCN)可用于制造丙烯腈和丙烯酸树脂,HCN分子中含4对极性共价键.
(3)NaNO2是一种白色易溶于水的固体,俗称工业盐.其水溶液显碱性,则该溶液中离子浓度由大到小的顺序是c(Na+)>c(NO2-)>c(OH-)>c(H+).
(4)氰化钠是一种剧毒物质,处理该物质的方法之一是在碱性条件下通入氯气,其中CN-被氧化成CO32-和N2,写出该反应的离子方式2CN-+5Cl2+12OH-═2CO32-+N2+10Cl-+6H2O.
分析 (1)比较非金属性的强弱,可根据最高价氧化物对应水化物的酸性强弱,与氢气反应的剧烈程度,氢化物的稳定性,单质之间的置换反应等,对应阴离子的还原性强弱等;
(2)结合HCN结构和分子中的化学键分析,每一对共用电子对为一个共价键;
(3)NaNO2是一种白色易溶于水的固体,俗称工业盐.其水溶液显碱性是因为亚硝酸根离子水解溶液显碱性;
(4)氯气将CN-氧化成无污染的气体,反应生成二氧化碳在碱溶液中生成碳酸盐、氮气,氯气被还原为离子.
解答 解:(1)a.氢化物的稳定性越强,其非金属性越强,已知氢化物稳定性:H2O>NH3 ,则非金属性O大于N,故a正确;
b.氢化物的沸点属于物理性质,与元素的非金属性无关,所以不能根据沸点:H2O>NH3,来比较O与N的非金属性,故b错误;
c.化合物中非金属性强的元素吸引电子能力强先负价,已知NO中N为+2价,O为-2价,所以非金属性O大于N,故c正确;
d.不能根据氢化物的碱性判断元素的非金属性,故d错误;
故答案为:ac;
(2)HCN分子结构为H-C≡N,每一对共用电子对为一个共价键,所以分子中含有4对极性共价键,
故答案为:4;
(3)NaNO2是一种白色易溶于水的固体,俗称工业盐.其水溶液显碱性是因为亚硝酸根离子水解溶液显碱性,溶液中离子浓度大小为:c(Na+)>c(NO2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(NO2-)>c(OH-)>c(H+);
(4)氯气将CN-氧化成无污染的气体,反应生成二氧化碳在碱溶液中生成碳酸根离子、氮气,氯气被还原为离子,反应离子方程式为:2CN-+5Cl2+12OH-═2CO32-+N2+10Cl-+6H2O,
故答案为:2CN-+5Cl2+12OH-═2CO32-+N2+10Cl-+6H2O.
点评 本题考查了元素非金属性强弱的判断、氧化还原反应、离子浓度大小比较等,题目难度中等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,注意把握电离常数与酸性强弱的关系.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| 编号 元素 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Li,⑧的元素名称是硼.①在元素周期表中的位置是(周期、族)第二周期第VIA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式是:
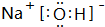 ; 属离子化合物(填“离子”或“共价”).
; 属离子化合物(填“离子”或“共价”). (3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
| A. | 三个烧杯中均会发生的离子反应为2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 三个烧杯中钠均在液面上剧烈反应,且X烧杯中反应最剧烈 | |
| C. | 三个烧杯反应后,生成的溶质的物质的量浓度相同 | |
| D. | 三个烧杯反应后,生成的气体的质量一定相同 |
| A. | Ca(ClO)2 | B. | CI2 | C. | CaCl2 | D. | Ca(OH)2 |

 尿素[CO(NH2)2]是首个由无机物人工合成的有机物
尿素[CO(NH2)2]是首个由无机物人工合成的有机物