题目内容
5.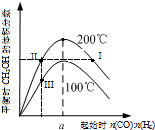 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )| A. | 反应CO(g)+2H2(g)?CH3OH(g)的△H<0 | |
| B. | 图示a点n(CO):n(H2)=0.5,CO转化率最高 | |
| C. | 若在状态Ⅰ和Ⅱ时,再向体系中充入He,重新达到平衡:c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ) | |
| D. | 正反应速率ν正:ν正(状态Ⅱ)>ν正(状态Ⅲ) |
分析 A.当起始n(CO):n(H2)相同时,升高温度,平衡时CH3OH的体积分数增大,说明平衡正向移动,则正反应为吸热反应;
B.起始n(CO):n(H2)越大,c(CO)的起始浓度越大,在同温同体积条件下,相当于增大压强,平衡正向移动;
C.同温同压下,向体系中充入He,不影响组分浓度,对化学平衡状态无影响;
D.温度升高,化学反应速率增大.
解答 解:A.当起始n(CO):n(H2)相同时,升高温度,平衡时CH3OH的体积分数增大,说明平衡正向移动,则正反应为吸热反应,即反应CO(g)+2H2O(g)?CH3OH(g)的△H>0,故A错误;
B.随着起始n(CO):n(H2)越大,c(CO)的起始浓度越大,在同温同体积条件下,相当于增大压强,平衡正向移动,CO转化率逐渐增大,故B错误;
C.同温同压下,向体系中充入He,不影响组分浓度,对化学平衡状态无影响,因此c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ),故C正确;
D.状态Ⅱ是200℃,状态Ⅲ是100℃,升高温度,化学反应速率增大,因此v正(状态Ⅱ)>v正(状态Ⅲ),故D正确;
故选CD.
点评 本题考查化学平衡状态的建立和平衡移动,为高频考点,B选项为该题的难点,注意同温同压下,增大c(CO)等效于增大压强,题目难度中等.

练习册系列答案
相关题目
16.有aX n+、b Ym-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
| A. | b-a=n+m | B. | a-b=n+m | C. | 核电荷数:Y>X | D. | 质子数:Y>X |
13.短周期主族元素W、R、X、Y、Z,原子序数依次增大.W、X、Y三种元素原子的最外层电子数之和为15,Y原子核电荷数等于W原子核电荷数的2倍,R原子最外层电子数与X原子最外层电子数相差1.下列叙述正确的是( )
| A. | R在化合物中显+1价 | B. | 最高价氧化物的水化物的碱性:X>R | ||
| C. | 原子半径:W<R<X | D. | R与Z可以形成离子化合物 |
20.下列反应既能属于氧化还原反应,又属于吸热反应的是( )
| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 硫在氧气中的燃烧反应 |
14.可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列表示放电时的负极反应的是( )
| A. | Zn-2e-=Zn2+ | B. | Br2+2e-=2Br- | C. | 2Br--2e-=Br2 | D. | Zn2++2e-=Zn |
15.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55℃-60℃反应生成硝基苯 | |
| B. | 苯在合适条件下催化加氢可生成环己烷 | |
| C. | 丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷 | |
| D. | 甲苯与溴蒸气在光照条件下反应主要生成邻溴甲苯和对溴甲苯 |
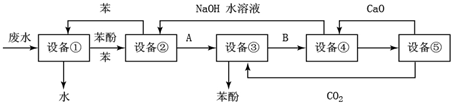 回答下列问题:
回答下列问题: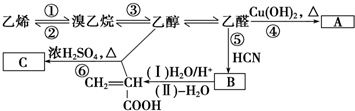
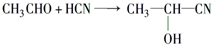 ;加成反应.
;加成反应.