题目内容
11.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A (g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示.下列说法正确的是( )
| A. | 前20min B的平均反应速率为0.05mol•L-1•S-1 | |
| B. | 8 min时表示正反应速率等于逆反应速率 | |
| C. | 反应方程式中的x=1,30 min时表示增大压强 | |
| D. | 40 min时改变的条件是升高温度,且正反应为放热反应 |
分析 由图象可知,30min时反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,
由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,以此解答该题.
解答 解:由上述分析可知,反应为A (g)+B(g)?2C(g),
A.由图象可知,0~20minA的浓度变化为1mol/L,v(A)=$\frac{1mol/L}{20min}$=0.05mol•L-1•min-1,由速率之比等于化学计量数之比可知前20min B的平均反应速率为0.05mol•L-1•min-1,速率单位不一致,故A错误;
B.8 min时反应物的浓度在减小,生成物浓度增大,表示正反应速率大于逆反应速率,故B错误;
C.由分析可知,x=1,30 min时改变的条件是减小压强,故C错误;
D.40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故D正确;
故选D.
点评 本题考查物质的量浓度与时间的变化曲线,为高频考点,把握图中浓度的变化、平衡判断、压强和温度对平衡的影响为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
1.不同元素的原子在分子内吸引电子的能力大小可用一数值X来表示,若X越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方.下面是某些短周期元素的X值.
(1)通过分析X值的变化规律,确定N、Mg的X值范围:0.93<X(Mg)<1.57;2.55<X(N)<3.44.
(2)推测X值与原子半径的关系是同周期(或同主族)元素,x值越大,原子半径越小.
(3)某有机物结构简式为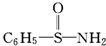 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
(4)经验规律告诉我们当成键的两原子相应元素电负性的差值△X>1.7时,一般为离子键,当△X<1.7时,一般为共价键,试推断AlBr3中化学键的类型是共价键
(5)预测元素周期表中,X值最小的元素位置第六周期第ⅠA族(放射性元素除外).
| 元素 | Li | Be | B | C | O | F |
| X值 | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| X值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)推测X值与原子半径的关系是同周期(或同主族)元素,x值越大,原子半径越小.
(3)某有机物结构简式为
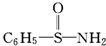 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).(4)经验规律告诉我们当成键的两原子相应元素电负性的差值△X>1.7时,一般为离子键,当△X<1.7时,一般为共价键,试推断AlBr3中化学键的类型是共价键
(5)预测元素周期表中,X值最小的元素位置第六周期第ⅠA族(放射性元素除外).
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA | |
| B. | 1L0.1mol•L-1碳酸钠溶液中含有的氧原子数为0.3NA | |
| C. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 0.1 mol乙烯和乙醇的混合物完全燃烧所消耗的氧分子数为0.3NA |
19. 20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示.下列说法正确的是( )
20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示.下列说法正确的是( )
 20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示.下列说法正确的是( )
20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示.下列说法正确的是( )| A. | 0.100 mol•L-1的NaHC2O4溶液中:c(OH-)═c(H+)-2c(C2O42-)+c(H2C2O4) | |
| B. | Q点:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| C. | P点:c(Na+)+c(H2C2O4)<0.100 mol•L-1+c(HC2O4-) | |
| D. | 该温度下H2C2O4的电离平衡常数Ka2=1×10-42mol•L-1 |
6.下列说法正确的是( )
| A. | 乙烯可用于制取乙醇,属于水解反应 | |
| B. | 为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 | |
| C. | 乙醇和葡萄糖均能发生酯化反应 | |
| D. |  的单体是:CH3-C≡C-CH3 和CH2=CH-CN 的单体是:CH3-C≡C-CH3 和CH2=CH-CN |
16.某原子电子排布式为1s22s22p3,下列说法正确的是( )
| A. | 该元素位于第二周期 IIIA族 | |
| B. | 核外有3种能量不同的电子 | |
| C. | 最外层电子占据3个轨道 | |
| D. | 最外层上有3种运动状态不同的电子 |
3.X是某药物的中间体,其结构简式如图所示.下列有关X的说法正确的是( )

| A. | 每个X分子中含有5个手性碳原子 | |
| B. | 一定条件下,X能与乙醇发生酯化反应 | |
| C. | 一定条件下,X能发生消去反应 | |
| D. | X既能与盐酸反应,又能与NaOH溶液反应 |
1.用下列实验装置完成对应的实验,不能达到实验目的是( )
| A. |  量取10.00mLNaOH溶液 | |
| B. |  蒸干氯化铜溶液制CuCl2•2H2O | |
| C. |  关闭活塞a,从b处加水,以检查装置的气密性 | |
| D. |  用CO2做喷泉实验 |
2.化学与生产、生活、社会密切相关,下列说法错误的是( )
| A. | 氯气处理饮用水,在冬季的杀菌效果比在夏季好 | |
| B. | 中国古代利用明矾溶液的酸性来清除铜镜表面的铜锈 | |
| C. | 食盐、漂白粉均可以将某些病毒氧化而达到消毒的目的 | |
| D. | 白葡萄酒含维生素C等多种维生素,通常添加微量SO2,以防止营养成分被氧化 |