题目内容
19. 20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示.下列说法正确的是( )
20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示.下列说法正确的是( )| A. | 0.100 mol•L-1的NaHC2O4溶液中:c(OH-)═c(H+)-2c(C2O42-)+c(H2C2O4) | |
| B. | Q点:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| C. | P点:c(Na+)+c(H2C2O4)<0.100 mol•L-1+c(HC2O4-) | |
| D. | 该温度下H2C2O4的电离平衡常数Ka2=1×10-42mol•L-1 |
分析 A.0.100 mol•L-1的NaHC2O4溶液中存在物料守恒和电荷守恒;
B.依据图象可知Q点pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)<c(HC2O4-);
C.P点c(HC2O4-)=c(C2O42-)的溶液中c(Na+)<0.100 mol•L-1+c(HC2O4-);
D.P点c(HC2O4-)=c(C2O42-),该温度下H2C2O4的电离平衡常数Ka2=$\frac{c({C}_{2}{{O}_{4}}^{2-})c({H}^{+})}{c(H{C}_{2}{{O}_{4}}^{-})}$;
解答 解:A.0.100 mol•L-1的NaHC2O4溶液中存在物料守恒,c(Na+)=c(C2O42-)+c(H2C2O4)+c(HC2O4-),电荷守恒c(Na+)+c(H+)=2c(C2O42-)+c(OH-)+c(HC2O4-),计算得到c(OH-)+c(C2O42-)═c(H+)+c(H2C2O4),故A错误;
B.由图象可知,Q点pH=2.5的溶液中c(H2C2O4)和c(C2O42-)浓度之和小于c(HC2O4-),则c(H2C2O4)+c(C2O42-)<c(HC2O4-),故B错误;
C.c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1,c(HC2O4-)=c(C2O42-),电荷守恒(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-),pH约4.2,此时氢离子浓度大于氢氧根,得到溶液中c(Na+)+c(H2C2O4)<0.100 mol•L-1+c(HC2O4-),故C正确;
D.P点c(HC2O4-)=c(C2O42-),该温度下H2C2O4的电离平衡常数Ka2=$\frac{c({C}_{2}{{O}_{4}}^{2-})c({H}^{+})}{c(H{C}_{2}{{O}_{4}}^{-})}$=c(H+)=1×10-42mol•L-1 ,故D正确;
故选CD.
点评 本题考查了弱电解质的电离、离子浓度大小比较,侧重于学生的分析能力的考查,注意把握物料守恒、电荷守恒的运用,答题时注意体会,题目难度中等.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | Na2S2O3溶液与H2SO4溶液混合:S2O32-+4H+═SO42-+S↓+2H2O | |
| B. | 硝酸银溶液中滴入少量氨水:Ag++2NH2•H2O═[Ag(NH3)2]++2H2O | |
| C. | AgI悬浊液中滴入适量Na2S溶液:2AgI+S2-═Ag2S+2I- | |
| D. | Fe(SCN)3溶液中滴入几滴0.01mol/LNaOH溶液:Fe3++3OH-═Fe(OH)3↓ |
| A. | “凡造竹纸…用上好石灰化汁涂浆”,造纸利用了石灰的碱性 | |
| B. | “曾青(硫酸铜)涂铁,铁赤色如铜”,过程中发生了置换反应 | |
| C. | 三聚氰胺可用于食品添加剂 | |
| D. | 含Ca(HCO3)2的硬水可通过煮沸的方法使之软化 |
| A. | 化石燃料燃烧和工业废气中的氮氧化物是导致“雾霾天气”的原因之一 | |
| B. | 纤维素、淀粉、脂肪、蛋白质都是高分子化合物 | |
| C. | 用含有铁粉的透气小袋与食品一起密封包装来防止食品氧化 | |
| D. | 化学药品着火,都要立即用水或泡沫灭火器灭火 |
| A. | 中子数为14的铝原子:${\;}_{13}^{14}$Al | B. | 次氯酸的电子式 | ||
| C. | O2-的结构示意图: | D. | 聚四氟乙烯的结构简式: |
| A. | 煤制乙醇,有利于保护环境,实现能源充分利用 | |
| B. | 煤制乙醇可缓解靠发酵产生乙醇导致的“与人类争粮”的局面 | |
| C. | 等物质的量的乙醇.汽油完全燃烧,乙醇放出的热量多 | |
| D. | 乙醇是世界公认的优良汽油添加剂,可有效改善汽油品质 |
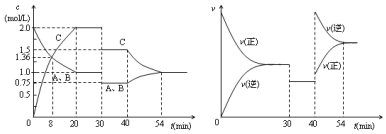
| A. | 前20min B的平均反应速率为0.05mol•L-1•S-1 | |
| B. | 8 min时表示正反应速率等于逆反应速率 | |
| C. | 反应方程式中的x=1,30 min时表示增大压强 | |
| D. | 40 min时改变的条件是升高温度,且正反应为放热反应 |
| A. | 糖类和蛋白质都属于天然高分子化合物 | |
| B. | 异丁烷的结构简式为 | |
| C. | CH3COOH和C2H518OH反应,生成CH3COOC2H5和H218O | |
| D. |  能与溴水发生加成反应 能与溴水发生加成反应 |
 常温下向某浓度的氯水中逐滴滴入Na2SO3溶液,无气体逸出,溶液pH变化如图所示,下列关系错误的是( )
常温下向某浓度的氯水中逐滴滴入Na2SO3溶液,无气体逸出,溶液pH变化如图所示,下列关系错误的是( )| A. | a点:c(H+)>c(Cl-)>c(ClO-) | |
| B. | b点:$\frac{1}{2}$ c(Cl-)=c(SO42-)=0.005 mol•L-1 | |
| C. | c点:c(Na+)=2c(HSO3-)+2c(SO32-)+2c(SO42-) | |
| D. | d点:c(Na+)=c(Cl-)+2c(SO32-)+c(HSO3-)+2c(SO42-) |