题目内容
18.为了证明一水合氨(NH3•H2O)是弱电解质,常温下做以下实验没有意义的是( )| A. | 用pH试纸测出0.010mol/L氨水的pH为10 | |
| B. | 用pH试纸测定0.10mol/LNH4Cl溶液为pH<7 | |
| C. | 取出10mL0.010mol/L氨水,滴入2滴酚酞溶液,显粉红色,再加入NH4C1晶体少量,颜色变浅 | |
| D. | 取出10mL0.010mol/L氨水,滴入2滴酚酞溶液,显粉红色,再稀盐酸少量,颜色变浅 |
分析 一水合氨是弱电解质,氨水的电离方程式为:NH3•H2O?NH4++OH-证明一水合氨是弱电解质,需证明一水合氨的电离是部分电离,据此分析.
解答 解:A、0.010mol/L氨水的pH为10,说明一水合氨的电离是部分电离,故A不选;
B、0.10mol/LNH4Cl溶液为pH<7,说明氯化铵是强酸弱碱盐,故B不选;
C、向氨水中加入氯化铵晶体,颜色变浅,说明一水合氨存在电离平衡,为弱电解质,故C不选;
D、向氨水中加入盐酸发生了中和反应,不能证明一水合氨是弱电解质,故D选;
故选D.
点评 本题考查了弱电解质的判断,注意对概念的把握,在溶液中部分电离的电解质为弱电解质,题目难度不大.

练习册系列答案
相关题目
8.在甲、乙、丙三种溶液中各含有Cl-、Br-、I-中的一种,向甲溶液中加入淀粉溶液和氯水时,溶液变成橙色,再加入乙溶液时,溶液颜色没有明显变化,则甲、乙、丙溶液中依次含的离子为( )
| A. | Cl-、Br-、I- | B. | Br-、I-、Cl- | C. | Br-、Cl-、I- | D. | Cl-、I-、Br- |
9.卤族元素及其化合物在生活中应用广泛.下列有关说法正确的是( )
| A. | 氟氯烃作制冷剂会加剧雾霾天气的形成 | |
| B. | 从海水中提取溴需经历氧化还原反应 | |
| C. | 加碘食盐中含有碘元素,能使淀粉溶液变蓝 | |
| D. | 工业上制漂白粉,所得的氯化物都具有漂白性 |
13.下列说法正确的是( )
| A. | ${\;}_{17}^{37}$Cl表示质子数为17、中子数为20的核素 | |
| B. | 乙二醇(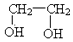 )和甘油( )和甘油(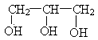 )互为同系物 )互为同系物 | |
| C. | 干冰和CO2互为同分异构体 | |
| D. | 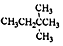 的名称是3,3-二甲基丁烷 的名称是3,3-二甲基丁烷 |
3. 过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
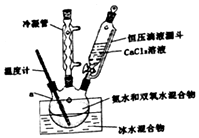
(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图、反应装置如图所示,请回答下列问题:
实验步骤:
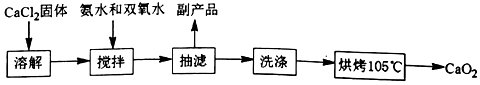
(1)仪器a的名称三颈烧瓶;
(2)①沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少H2O2受热分解;降低氨的挥发;降低温度促使产物析出(写出两点)
②过滤后洗涤沉淀的试剂最好用B.
A.热水 B.冷水 C.乙醇 D.乙醚
(3)某同学设计的实验装置示意图(如图,夹持装置及冷凝水省略)有一处不合理,请提出改进方案并说明理由温度计应该为搅拌器.该反应需要不断搅拌,且冰水浴条件无需温度计.
(Ⅱ)产品稳定性分析:取所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol•L-1酸性高锰酸钾溶液滴定生成H2O2(KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如表
已知:
①H2O2不稳定,加热,加入某些金属离子或加碱均有利于其分解.
②产品稳定性=$\frac{放置一个月后Ca{O}_{2}的质量分数}{放置前Ca{O}_{2}的质量分数}$×100%
(4)用KMnO4滴定,达到滴定终点时的现象是溶液由无色变淡紫色,且半分钟不褪色.
(5)该产品的“产品稳定性”=96%.
 过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图、反应装置如图所示,请回答下列问题:
实验步骤:

(1)仪器a的名称三颈烧瓶;
(2)①沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少H2O2受热分解;降低氨的挥发;降低温度促使产物析出(写出两点)
②过滤后洗涤沉淀的试剂最好用B.
A.热水 B.冷水 C.乙醇 D.乙醚
(3)某同学设计的实验装置示意图(如图,夹持装置及冷凝水省略)有一处不合理,请提出改进方案并说明理由温度计应该为搅拌器.该反应需要不断搅拌,且冰水浴条件无需温度计.
(Ⅱ)产品稳定性分析:取所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol•L-1酸性高锰酸钾溶液滴定生成H2O2(KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如表
| 数据 时间 | 样品取用质量/(g) | 平均消耗体积(KMnO4)/mL |
| 放置前测定 | a | 25.00 |
| 放置一个月后测定 | a | 24.00 |
①H2O2不稳定,加热,加入某些金属离子或加碱均有利于其分解.
②产品稳定性=$\frac{放置一个月后Ca{O}_{2}的质量分数}{放置前Ca{O}_{2}的质量分数}$×100%
(4)用KMnO4滴定,达到滴定终点时的现象是溶液由无色变淡紫色,且半分钟不褪色.
(5)该产品的“产品稳定性”=96%.
10.室温下,0.1mol/LNaClO溶液的pH大于0.1mol/LNa2SO3溶液的pH.(选填“大于”、“小于”,或“等于”).浓度均为0.1mol/L的Na2SO3和Na2SO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为.已知:
| Na2SO3 | Kal=1.54×l0-2 | Ka2=1.02×10-7 |
| HCIO | Ka1=2.95×10-8 | |
| H2CO3 | Kal=4.3×10-7 | Ka2=5.6×10-11 |
8.下列离子方程式书写正确的是( )
| A. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:HSO3-+OH-═SO32-+H2O | |
| C. | Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+═Fe2++2H2O | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
