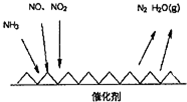
题目内容
14.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1molCl2与足量的铁粉反应,反应转移电子的数目为3NA | |
| B. | 室温时,足量Zn与浓硫酸反应共产生2mol气体,转移电子数为4NA | |
| C. | 7.8gNa2O2与足量水反应时转移电子数目为0.2NA | |
| D. | 1mol二氧化氮气体久置后在标准状况下的体积为22.4L |
分析 A、氯气和铁反应后变为-1价;
B、锌和浓硫酸反应生成二氧化硫;
C、求出过氧化钠的物质的量,然后过氧化钠和水反应时为歧化反应来分析;
D、NO2中存在平衡:2NO2?N2O4.
解答 解:A、氯气和铁反应后变为-1价,故1mol氯气反应转移2mol电子即2NA个,故A错误;
B、锌和浓硫酸反应生成二氧化硫,当生成1mol二氧化硫时转移2mol电子,故当生成2mol二氧化硫时,转移4mol电子即4NA个,故B正确;
C、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠和水反应时为歧化反应,故0.1mol过氧化钠转移0.1NA个电子,故C错误;
D、NO2中存在平衡:2NO2?N2O4,故1mol二氧化氮久置后在标况下的体积小于22.4L,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.现有溶质为Ba(0H)2、AlCl3、NH4HCO3和H2SO4的四瓶无标签溶液,分别取其中三种溶液于三支试管中,再依次向三支试管中滴加少许剩下的另一种溶液,并稍加热,则下列说法中错误的是( )
| A. | 若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是AlCl3溶液 | |
| B. | 若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是H2SO4 | |
| C. | 若两支试管中都只产生白色沉淀时,则滴加的是Ba(0H)2溶液 | |
| D. | 若两支试管中既产生沉淀又出现气体时,则滴加的是NH4HCO3溶液 |
2.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4•5H2O)及副产物ZnO.制备流程图如图:
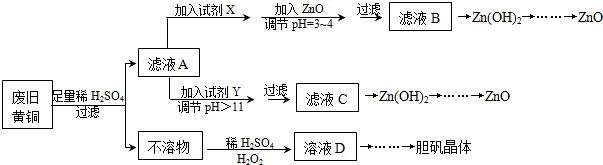
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
请回答下列问题:
(1)试剂X可能是H2O2,其作用是将Fe2+氧化为Fe3+.
(2)加入ZnO调节pH=3~4的目的是降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去.
(3)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤.
(5)下列试剂可作为Y试剂的是B.A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后溶解.
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-
①胆矾晶体的纯度为97.00%.
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会偏高(填“偏高”、“偏低”或“不变”).

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
(1)试剂X可能是H2O2,其作用是将Fe2+氧化为Fe3+.
(2)加入ZnO调节pH=3~4的目的是降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去.
(3)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤.
(5)下列试剂可作为Y试剂的是B.A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后溶解.
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-
①胆矾晶体的纯度为97.00%.
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会偏高(填“偏高”、“偏低”或“不变”).
9.将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.得到如表中的两组数据:
下列说法不正确的是( )
| 实验编号 | 温度/℃ | 平衡常数/mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | x=1.6,y=0.2,t<6 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | 实验1在前6 min的反应速率v (SO2)=0.2 mol•L-1•min-1 |
19.下列实驗装置、现象合理的是( )
| A. |  实验:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| B. |  实验:烧杯内Na2SiO3溶液变浑浊,可证明非金属性C>Si | |
| C. |  实驗:微笑热稀HN02,片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. |  实驗:利用该实驗装置可证明氧化性:Cl2>Br2 |
4.氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl.
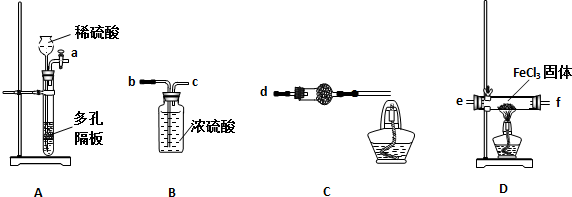
(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)气流从左至右,装置接口连接顺序是ab c e f d
(3)装置C中干燥管中所盛试剂的名称是:碱石灰或生石灰,作用是:除去HCl、并防止空气中水的进入
(4)装置C中酒精灯的作用是:燃烧H2,防止污染空气
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
①写出滴定过程中所发生的2个离子方程式:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
②样品中氯化亚铁的质量分数为70.1%.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl.

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)气流从左至右,装置接口连接顺序是ab c e f d
(3)装置C中干燥管中所盛试剂的名称是:碱石灰或生石灰,作用是:除去HCl、并防止空气中水的进入
(4)装置C中酒精灯的作用是:燃烧H2,防止污染空气
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
②样品中氯化亚铁的质量分数为70.1%.
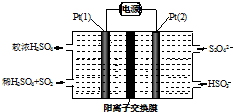 工业尾气SO2有多种吸收和处理方法.
工业尾气SO2有多种吸收和处理方法.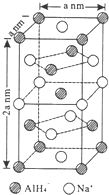 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.  .
. 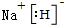 .
. 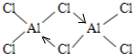 (标明配位键).
(标明配位键).