题目内容
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.12.5mL 16mol/L浓硫酸与足量锌充分反应,转移电子数为0.2NA
B.5.8g熟石膏(2CaSO4 H2O)含有的结晶水分子数为0.02NA
C.4.6g C2H6O中含C-H键数为0.6NA
D.1L甲醛气体完全燃烧消耗O2的数目约为![]()
【答案】B
【解析】
A.浓硫酸与锌发生反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,当反应进行到一定程度变为稀硫酸时发生反应:Zn+H2SO4(稀)=ZnSO4+H2↑, n(H2SO4)=cV=16mol/L×0.0125L=0.2mol,若完全发生第一个反应,转移电子的数目为0.2NA,若发生第二个反应,转移电子数目为0.4NA,因此反应转移电子数目大于0.2NA,小于0.4NA,故A错误;
B.熟石膏(2CaSO4 H2O)摩尔质量是290g/mol,则5.8g熟石膏的物质的量n=![]() =0.02mol,由于熟石膏中(2CaSO4 H2O)~H2O,所以0.02mol该物质中含有的结晶水分子数为0.02NA,故B正确;
=0.02mol,由于熟石膏中(2CaSO4 H2O)~H2O,所以0.02mol该物质中含有的结晶水分子数为0.02NA,故B正确;
C.C2H6O相对分子质量都是92,则4.6g C2H6O物质的量是0.1mol,由于C2H6O可能有的结构为CH3CH2OH和CH3OCH3,两种结构中1分子含有的C-H键分别为5个和6个,所以4.6g C2H6O中含C-H键数不一定为0.6NA,故C错误;
D.甲醛气体,若在标准状况下1L的物质的量为n(甲醛)=![]() ,1mol甲醛完全燃烧消耗1mol O2,则1L甲醛气体完全燃烧消耗O2的物质的量是
,1mol甲醛完全燃烧消耗1mol O2,则1L甲醛气体完全燃烧消耗O2的物质的量是![]() ,消耗氧气的分子个数约为
,消耗氧气的分子个数约为![]() ,而题目中缺少“在标准状况下”限制,故D错误;
,而题目中缺少“在标准状况下”限制,故D错误;
答案选B。

【题目】研究发现,反应CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2![]() CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | α1 |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
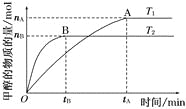
(3)120 ℃时,分别进行H

①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。