题目内容
【题目】蛋白质是构成生物体的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)在基态![]() 原子中,核外电子占据的最高能级的电子云轮廓图为________形。
原子中,核外电子占据的最高能级的电子云轮廓图为________形。
(2)常见的含氮微粒有![]() 、
、![]() 、
、![]() 等。与
等。与![]() 互为等电子体的分子为________(写出一种)。根据价层电子对互斥理论,可推知
互为等电子体的分子为________(写出一种)。根据价层电子对互斥理论,可推知![]() 的空间构型为________,
的空间构型为________,![]() 比
比![]() 更容易液化的原因是________。
更容易液化的原因是________。
(3)将足量的氨水逐滴加入到![]() 溶液中,先生成沉淀,然后沉淀溶解生成配合物
溶液中,先生成沉淀,然后沉淀溶解生成配合物![]() ,该配合物中的阳离子结构式为________;
,该配合物中的阳离子结构式为________;![]() 中的硫原子杂化方式为________;用价层电子对互斥理论解释
中的硫原子杂化方式为________;用价层电子对互斥理论解释![]() 的键角大于
的键角大于![]() :________。
:________。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:晶胞中与Zn原子距离最近的Te原子围成________形;与Te原子距离最近的Te原子有________个;若与Zn原子距离最近的Te原子间距为apm,则晶体密度为________![]() (列出计算式即可)。
(列出计算式即可)。

【答案】哑铃(或纺锤) ![]() 或
或![]() V形 液氨存在分子间氢键,沸点高于
V形 液氨存在分子间氢键,沸点高于![]() ,故
,故![]() 比
比![]() 更易液化
更易液化 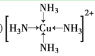
![]() 两种离子的中心硫原子均为
两种离子的中心硫原子均为![]() 杂化,
杂化,![]() 中没有孤对电子,
中没有孤对电子,![]() 有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小 正四面体 12
有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小 正四面体 12 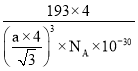
【解析】
(1)N原子的外围电子的最高能级为2p能级;
(2)NO3-中N的价电子数为5,离子带一个单位负电荷,相当价电子数为6 的S原子,据此分析书写等电子体;根据价层电子对个数=σ键个数+孤电子对个数,计算判断NH2-的VSEPR;结合氢键形成条件分析判断;
(3)该配离子中Cu原子提供空轨道、N原子提供孤电子对而形成配位键;根据价层电子对个数=σ键个数+孤电子对个数推断SO42-的和SO32-的VSEPR模型,结合孤电子对会成键电子对的排斥力大于成键电子对之间的排斥力分析键角大小;
(4)根据均摊法结合图象分析计算;顶点与面心的Te原子之间距离最短,每个顶点为8个晶胞共用,每个面为2个晶胞共用;与Zn原子距离最近的Te原子间距等于晶胞体对角线长的![]() 倍,根据均摊法计算晶胞中Te、Zn原子数目,结合原子的摩尔质量计算晶胞质量,再根据ρ=
倍,根据均摊法计算晶胞中Te、Zn原子数目,结合原子的摩尔质量计算晶胞质量,再根据ρ=![]() 计算晶体密度。
计算晶体密度。
(1)N原子的外围电子排布式为2s22p3,最高能级为2p,p轨道为哑铃形,故答案为:哑铃;
(2)NO3-中N的价电子数为5,离子带一个单位负电荷,相当价电子数为6 的S原子,所以与NO3-互为等电子体的分子为SO3;NH2-中N的价层电子对数为2+![]() =4,含有两对孤电子对,VSEPR模型为四面体,略去孤电子对,得到NH2-的空间构型为V形;NH3中含有电负性大的N原子、并且有N-H键,符合氢键形成条件,所以NH3分子间存在氢键,沸点高于PH3,导致NH3比PH3更容易液化,故答案为:SO3;v形;液氨存在分子间氢键,沸点高于PH3,所以NH3比PH3更容易液化;
=4,含有两对孤电子对,VSEPR模型为四面体,略去孤电子对,得到NH2-的空间构型为V形;NH3中含有电负性大的N原子、并且有N-H键,符合氢键形成条件,所以NH3分子间存在氢键,沸点高于PH3,导致NH3比PH3更容易液化,故答案为:SO3;v形;液氨存在分子间氢键,沸点高于PH3,所以NH3比PH3更容易液化;
(3)该配离子中Cu原子提供空轨道、N原子提供孤电子对而形成配位键,其结构为 ;SO42-中S的价层电子对数为4+
;SO42-中S的价层电子对数为4+![]() =4,没有孤电子对,VSEPR模型分别为正四面体,SO42-中的硫原子杂化方式为sp3杂化; SO3/span>2-中S的价层电子对数为3+
=4,没有孤电子对,VSEPR模型分别为正四面体,SO42-中的硫原子杂化方式为sp3杂化; SO3/span>2-中S的价层电子对数为3+![]() =4,有1个孤电子对,VSEPR模型分别为四面体,由于SO42-中没有孤对电子、SO32-有一对孤对电子,孤电子对和成键电子对间的排斥力大于成键电子对之间的排斥力,孤电子对对成键电子有挤压作用,所以SO32-的键角更小,故答案为:
=4,有1个孤电子对,VSEPR模型分别为四面体,由于SO42-中没有孤对电子、SO32-有一对孤对电子,孤电子对和成键电子对间的排斥力大于成键电子对之间的排斥力,孤电子对对成键电子有挤压作用,所以SO32-的键角更小,故答案为: ;sp3;两种离子的中心硫原子均为sp3杂化,SO42-中没有孤对电子、SO32-有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小。
;sp3;两种离子的中心硫原子均为sp3杂化,SO42-中没有孤对电子、SO32-有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小。
(4)由图可知中与Zn原子距离最近的Te原子围成正四面体;顶点与面心的Te原子之间距离最短,每个顶点为8个晶胞共用,每个面为2个晶胞共用,与Te原子距离最近的Te原子有![]() ×3×8=12;
×3×8=12;
Zn原子处于晶胞内部,Zn原子数目=4,Te原子处于晶胞的顶点、面心,晶胞中Te原子数目=8×![]() +6×
+6×![]() =4,晶胞质量=
=4,晶胞质量=![]() g,与Zn原子距离最近的Te原子间距为apm,该距离等于晶胞体对角线长的
g,与Zn原子距离最近的Te原子间距为apm,该距离等于晶胞体对角线长的![]() 倍,即晶胞边长为
倍,即晶胞边长为![]() pm,晶胞体积V=(
pm,晶胞体积V=(![]() ×1010)3cm3,所以晶体密度ρ=
×1010)3cm3,所以晶体密度ρ=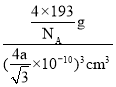 =
=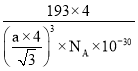 g/cm3,故答案为:正四面体;12;
g/cm3,故答案为:正四面体;12;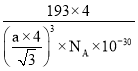 。
。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案