题目内容
20.下列有关化学用语或名称,表达错误的是( )| A. | COCl2分子的结构式: | B. | 苯分子的比例模型: | ||
| C. | NaOH的电子式: | D. |  的名称:2-乙基丁烷 的名称:2-乙基丁烷 |
分析 A.COCl2分子中含有两个C-Cl键和1个碳氧双键;
B.苯分子中所有碳碳键都相同,为平面结构;
C.氢氧化钠为离子化合物,电子式中阴阳离子都需要标出所带电荷.
D.该命名中选取的主链不是最长碳链.
解答 解:A.COCl2分子中C、O、Cl原子都满足8电子稳定结构,其结构式为: ,故A正确;
,故A正确;
B.苯分子为平面结构,碳原子相对体积大于氢原子,其比例模型为: ,故B正确;
,故B正确;
C.NaOH中含有1个钠离子和1个氢氧根离子其的电子式为 ,故C正确;
,故C正确;
D. 的最长碳链含有5个C,主链为戊烷,正确名称为:3-甲基戊烷,故D错误;
的最长碳链含有5个C,主链为戊烷,正确名称为:3-甲基戊烷,故D错误;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、结构式、比例模型及有机物命名等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
10.为了更好的掌握周期表的应用,某同学在做氯、溴、碘性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象
请你帮助该同学整理并完成实验报告.
(1)实验目的:研究同主族元素性质递变规律.
(2)实验用品:试剂:氯水,溴水,NaBr溶液,KI溶液,CCl4溶液
玻璃仪器:①试管②胶头滴管.
(3)此实验的结论为同主族元素从上到下随原子序数递增非金属递减.
(4)氟氯溴碘气态氢化物稳定性大小顺序(用分子式表示):HF>HCl>HBr>HI.
(5)该同学又做了另外一个实验,向新制得的Na2S溶液中滴加新制的氯水.该实验现象为生成淡黄色沉淀.
此反应的离子方程式Cl2+S2-=S↓+2Cl-.
此实验的结论为氧化性Cl2>S.
| 实验步骤 | 实验现象[ |
| ①将少量的氯水滴入到适量NaBr溶液中,再滴入少量的CCl4溶液并用力振荡 | A.溶液分为上下两层,上层为无色,下层为橙红色 |
| ②将少量的溴水滴入到适量KI溶液中,再滴入少量的CCl4溶液并用力振荡 | B.溶液分为上下两层,上层为无色,下层为紫红色 |
(1)实验目的:研究同主族元素性质递变规律.
(2)实验用品:试剂:氯水,溴水,NaBr溶液,KI溶液,CCl4溶液
玻璃仪器:①试管②胶头滴管.
(3)此实验的结论为同主族元素从上到下随原子序数递增非金属递减.
(4)氟氯溴碘气态氢化物稳定性大小顺序(用分子式表示):HF>HCl>HBr>HI.
(5)该同学又做了另外一个实验,向新制得的Na2S溶液中滴加新制的氯水.该实验现象为生成淡黄色沉淀.
此反应的离子方程式Cl2+S2-=S↓+2Cl-.
此实验的结论为氧化性Cl2>S.
11.两种气态烃的混合物共0.1mol,完全燃烧后得3.36LCO2 (标准状况下)和3.6gH2O.下列说法不正确的是( )
| A. | 一定有甲烷 | B. | 一定有乙烯 | ||
| C. | 一定没有乙烷 | D. | 可能是甲烷和乙烯的混合物 |
8.下列关于苯的说法中,正确的是( )
| A. | 苯不能使酸性KMnO4溶液褪色,属于饱和烃 | |
| B. | 常温下苯是一种易溶于水且密度比水小的液体 | |
| C. | 苯不具有典型的双键,故苯不能发生加成反应 | |
| D. | 苯分子为平面正六边形结构,6个碳原子之间的价键完全相同 |
5.某元素B的核电荷数为Z,已知Bn-和Am+的核外具有相同的电子层结构,则A元素的原子序数用Z、n、m来表示,应为( )
| A. | Z+n-m | B. | Z+m+n | C. | Z-n-m | D. | Z-n+m |
9.X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子数是最内层电子数的2倍;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子形成的-2价简单阴离子的核外电子排布与K+相同.下列有关这些元素性质的说法一定正确的是( )
| A. | X元素的氢化物的水溶液显碱性 | |
| B. | Y元素最高价氧化物的晶体具有很高的熔点和沸点 | |
| C. | Z元素的单质在一定条件下能与X元素的单质反应 | |
| D. | W元素的氧化物对应水化物均为强酸 |
10.将下列物质的溶液在蒸发皿中加热蒸干并灼烧,可得到该物质的固体的是( )
| A. | MgCl2 | B. | NH4Cl | C. | Na2CO3 | D. | KMnO4 |

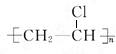 ,该反应类型是加聚反应
,该反应类型是加聚反应