题目内容
12.下列各组性质比较中,正确的是( )①失电子能力:K>Na>Li ②碱性:NaOH>Mg(OH)2>Al(OH)3 ③氧化性:F>Si>O ④稳定性:PH3<H2S<HCl.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
分析 元素的金属性越强,其原子失电子能力越强、其对应氧化物的水化物碱性越强;元素的非金属性越强,其得电子能力越强,则元素的氧化性越强、其氢化物的稳定性越强,据此分析解答.
解答 解:元素的金属性越强,其原子失电子能力越强、其对应氧化物的水化物碱性越强;元素的非金属性越强,其得电子能力越强,则元素的氧化性越强、其氢化物的稳定性越强,
①金属性:K>Na>Li,则失电子能力:K>Na>Li,故正确;
②金属性:Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3 ,故正确;
③非金属性:F>O>Si,则氧化性:F>O>Si,故错误;
④非金属性:Cl>S>P,则稳定性:PH3<H2S<HCl,故正确
故选C.
点评 本题考查了元素周期律的应用,明确元素周期律内涵是解本题关键,根据同一周期、同一主族元素的递变性来分析解答,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
20.向100mL由等物质的量的FeBr2和FeI2配成的混合溶液中,缓慢通入氯气3.36L(标准状况),反应完全后,溶液中有一半的Fe2+被氧化成Fe3+,则原混合液中FeI2的物质的量浓度为( )
| A. | 0.5 moL•L-1 | B. | 1.0 moL•L-1 | C. | 1.2 moL•L-1 | D. | 1.5 moL•L-1 |
3.下列分离方法正确的是( )
| A. | 用溶解后过滤的方法除去CaCl2中的少量的ZnSO4 | |
| B. | 用萃取的方法分离NaCl溶液和汽油 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用蒸馏的方法除去水中的不挥发的杂质 |
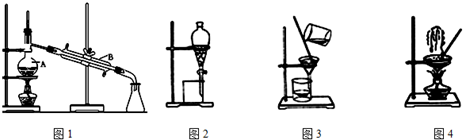
20.下列图示的化学实验操作中,正确的是( )
| A. |  倾倒液体 | B. |  取粉末状固体药品 | ||
| C. |  过滤 | D. |  浓硫酸的稀释 |
7.NA代表阿伏加德罗常数的值.下列叙述正确的是(相对原子质量:Fe---56)( )
| A. | 钢铁发生析氢腐蚀时,0.56gFe反应 转移电子数为0.03NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 1molH2O2分子中的非极性共价键 1NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4 NA |
2.X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构,下列说法正确的是( )
| A. | 原子最外层电子数:Z>Y>X | B. | 单质密度:Y>X>Z | ||
| C. | 离子半径:X2->Z->Y+ | D. | 原子序数:X>Z>Y |
 )
)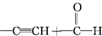 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$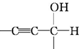
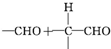 $\stackrel{稀NaOH}{→}$
$\stackrel{稀NaOH}{→}$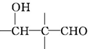
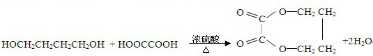 (注明条件).
(注明条件).