题目内容
4.NA为阿伏加德罗常数,下列叙述错误的是( )| A. | 18gH2O中含有的质子数为10NA | |
| B. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA | |
| C. | 46g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
分析 A、求出水的物质的量,然后根据1mol水中含10mol质子来分析;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、NO2和N2O4的最简式均为NO2;
D、根据反应后钠元素为+1价来分析.
解答 解:A、18g水的物质的量为1mol,而1mol水中含10mol质子,即10NA个,故A正确;
B、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氯气的物质的量小于1mol,而氯气和镁反应后变为-1价,故转移的电子数小于2NA个,故B错误;
C、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,则含有3NA个原子,故C正确;
D、由于反应后钠元素为+1价,故1mol钠反应失去1mol电子即NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
14.下列离子方程式书写正确的是( )
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
12.在密闭容器中发生反应:aA(g)+bB(g)?cC(g)+dD(g),达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡浓度的1.2倍.下列叙述正确的是( )
| A. | A的转化率变小 | B. | 平衡向逆反应方向移动 | ||
| C. | D的体积分数变大 | D. | a+b>c+d |
19. 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为l00L),在一定条件下发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g) I.
CH4的转化率与温度、压强的关系如图所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min)
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了实验设计表中.
表中剩余的实验条件数据:
n=150,m=$\frac{1}{3}$.
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为l00L),在一定条件下发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g) I.
CH4的转化率与温度、压强的关系如图所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min)
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了实验设计表中.
表中剩余的实验条件数据:
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | 1/3 | 0.1 |
| 2 | n | 1/3 | 5 |
| 3 | 350 | m | 5 |
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.
9.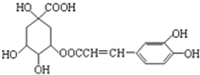 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )
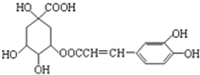 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )| A. | 分子式为C16H13O9 | |
| B. | 与浓溴水既能发生取代反应又能发生加成反应 | |
| C. | 1 mol咖啡鞣酸水解时可消耗8 mol NaOH | |
| D. | 能使酸性KMnO4溶液褪色,说明分子结构中有碳碳双键 |
16.在下列给定条件的溶液中,一定能大量共存的离子是( )
| A. | 滴加甲基橙试剂显红色的溶液中:Na +、Fe2+、Cl-、NO3- | |
| B. | 由水电离的c(H+)=1.0×10-13mol•L-1的溶液中:K +、Na +、AlO2-、CO3 2- | |
| C. | 常温下,pH=7 溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | KW/c(H+)=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- |
13.下列叙述不正确的是( )
| A. | 丁达尔效应可以区别溶液和胶体 | |
| B. | NaHCO3溶液中含有少量Na2CO3,可以用澄清石灰水除去 | |
| C. | 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 | |
| D. | 向品红溶液中通入SO2气体红色褪去,再加热恢复红色 |
14.可以将五种无色液体:C2H5OH、AgNO3溶液、C2H5Br、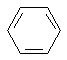 、KI溶液一一区分开的试剂是( )
、KI溶液一一区分开的试剂是( )
 、KI溶液一一区分开的试剂是( )
、KI溶液一一区分开的试剂是( )| A. | FeCl2溶液 | B. | NaOH溶液 | C. | 水 | D. | 溴水 |

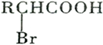
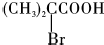 ;
; ,该反应类型为取代反应;
,该反应类型为取代反应;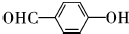 ;
;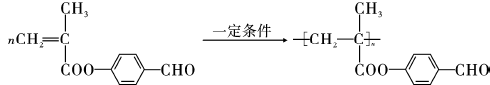 ;
;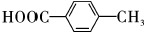 .
.