题目内容
6.氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行化学方法处理,可实现绿色环保、节能减排、废物利用等目的.(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-572kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
H2O(l)═H2O(g)△H2=+44kJ•mol-1
写出甲烷将NO2还原为N2并生成液态水时的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-954kJ•mol-1.
(2)工业上利用CO2生成甲醇燃料,反应为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
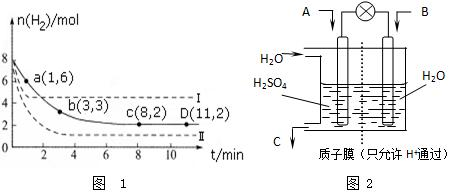
将6molCO2和8molH2充入容器为2L的密闭容器中(温度不变),H2的物质的量随时间变化如图实线所示(图中字母后的数字表示对应坐标).
①该反应在0~8min内CO2的平均反应速率为0.125mol•L-1•min-1.
②列式计算此温度下该反应的平衡常数K=$\frac{1×1}{2×1^3}$=0.5.
③第12min后,保持温度不变,向该密闭容器中再充入1molCO2(g)和3molH2O(g),则v正小于v逆(填“大于”、“小于”或“等于”).
④仅改变某一条件再进行实验,测得H2物质的量变化如虚线所示.与实线相比,曲线Ⅰ改变的条件可能是升温,曲线Ⅱ改变的条件可能是加压.
(3)采用如图2装置将SO2转化为重要化工原料.若A为SO2,B为O2,则A为负极,该极电极反应式为SO2-2e-+2H2O=4H++SO42-.
(4)常温下,Ksp(BaCO3)=2.5×10-9,Ksp(BaSO4)=1.0×10-10,欲用1LNa2CO3溶液将0.01molBaSO4转化为BaCO3,则c(Na2CO3)≥0.26mol/L.
分析 (1)已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-572kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
③H2O(l)═H2O(g)△H2=+44kJ•mol-1,
根据盖斯定律:(①+②)÷2-③×2可得CH4(g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(l),据此计算;
(2)①从图象可知0~8min内H2的物质的量反应了6mol,根据方程式,则0~8min内CO2的物质的量变化为2mol,再由v=$\frac{△c}{△t}$计算;
②从图象可知反应在8min平衡,将6molCO2和8molH2充入容器为2L的密闭容器,列三段式:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol/L):3 4 0 0
转化(mol/L):1 3 1 1
平衡(mol/L):2 1 1 1
根据化学平衡常数概念列式计算;
③计算向该密闭容器中再充入1molCO2(g)和3molH2O(g)的Qc,温度不变,K不变,与K比较,可得;
④曲线Ⅰ反应速率加快,平衡后的氢气比原平衡含量高,说明反应逆向移动,曲线Ⅱ反应速率加快,平衡时氢气含量降低,说明反应正向移动,结合影响化学平衡的因素分析可得;
(3)二氧化硫失电子和水反应生成硫酸根离子和氢离子,发生氧化反应,作负极;
(4)用1LNa2CO3溶液将0.01molBaSO4发生反应为:CO32-+BaSO4?BaCO3+SO42-,计算该反应的平衡常数K,0.01molBaSO4完全溶解生成n(SO42-)=0.01mol,c(SO42-)=0.01mol/L,结合溶解平衡表达式计算出碳酸钠的浓度.
解答 解:(1)已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-572kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
③H2O(l)═H2O(g)△H2=+44kJ•mol-1,
根据盖斯定律:(①+②)÷2-③×2可得CH4(g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(l)△H=-954kJ•mol-1;
故答案为:CH4(g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(l)△H=-954kJ•mol-1;
(2)①从图象可知0~8min内H2的物质的量反应了6mol,根据方程式,则0~8min内CO2的物质的量变化为2mol,所以0~8min内CO2的平均反应速率为$\frac{2mol÷2l}{8min}$=0.125 mol•L-1•min-1;
故答案为:0.125 mol•L-1•min-1;
②从图象可知反应在8min平衡,将6molCO2和8molH2充入容器为2L的密闭容器,列三段式:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol/L):3 4 0 0
转化(mol/L):1 3 1 1
平衡(mol/L):2 1 1 1
则化学平衡常数K=$\frac{1×1}{2×1^3}$=0.5;
故答案为:K=$\frac{1×1}{2×1^3}$=0.5;
③向该密闭容器中再充入1molCO2(g)和3molH2O(g),则此时Qc=$\frac{1.5×1}{2.5×1^3}$=0.6>K,则反应向着逆方向进行,v正<v逆;
故答案为:小于;
④曲线Ⅰ反应速率加快,平衡后的氢气比原平衡含量高,说明反应逆向移动,曲线Ⅱ反应速率加快,平衡时氢气含量降低,说明反应正向移动,反应速率加快且平衡发生移动的有升温和加压,反应是个放热、气体体积减小的反应,升高温度,平衡逆向移动,符合Ⅰ,增大压强,平衡正向移动,符合Ⅱ;
故答案为:升温; 加压;
(3)二氧化硫失电子和水反应生成硫酸根离子和氢离子,发生氧化反应,作负极,电极反应式为:SO2-2e-+2H2O=4H++SO42-;
故答案为:负;SO2-2e-+2H2O=4H++SO42-;
(4)碳酸钠与硫酸钡反应转化成碳酸钡的反应为:CO32-+BaSO4?BaCO3+SO42-,
该反应的平衡常数为:K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=$\frac{1×1{0}^{-10}}{2.5×1{0}^{-9}}$=0.04,0.01molBaSO4完全溶解生成n(SO42-)=0.01mol,c(SO42-)=0.01mol/L,设至少需要的c(Na2CO3)为x,
CO32-+BaSO4?BaCO3+SO42-,
起始:x 0
平衡:x-0.01 0.01
则有:K=$\frac{0.01}{x-0.01}$=0.04,解得x=0.26mol/L;
故答案为:0.26 mol/L.
点评 本题考查了盖斯定律,化学平衡的有关计算及影响化学平衡的因素,溶度积常数的应用,题目综合性较强,要求学生对基础知识的灵活运用,(4)题难度较大.

 阅读快车系列答案
阅读快车系列答案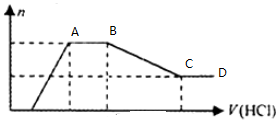
| A. | 溶液X中一定不含Cu2+、Mg2+、Al3+,可能含有Cl- | |
| B. | OA段参加反应的阴离子的物质的量之比为2:1或1:2 | |
| C. | AB段一定生成了气体 | |
| D. | BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
| A. | 葡萄糖 | B. | 食盐水 | C. | 硫酸钠溶液 | D. | 氢氧化钠 |
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(M) | |||
| ① | 700 | 0.40 | 0.10 | 0.090 | |
| ② | 800 | 0.10 | 0.40 | 0.080 | |
| ③ | 800 | 0.20 | 0.30 | a | |
| ④ | 900 | 0.10 | 0.15 | b | |
| A. | 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol•L-1•min-1 | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 实验④中,达到平衡时,b>0.060 |
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A. | 反应在前 5min 的平均速率为 v (SO2)=0.08mol•L-1•min-1 | |
| B. | 保持温度不变,向平衡后的容器中再充入 1molSO2和 0.5molO2时,v (正)>v (逆) | |
| C. | 该温度,反应的平衡常数为 11.25L•mol-1 | |
| D. | 相同温度下,起始时向容器中充入 1.5mol SO3,达平衡时 SO3的转化率为 40% |
| 物质 | X | Y | Z | Q |
| 时间 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
(1)2min内Z的反应速率v(Z)=0.05mol•L-1•min-1.
(2)试确定以下物质的相关量:起始时n(Y)=2.3mol,n(Q)=3mol.
(3)方程式中m=1,n=4,p=2,q=3.
(4)对于该反应,能增大正反应速率的措施是CD
A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度.
| A. | SO2+2H2S═S+2H2O | B. | 2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑ | ||
| C. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | D. | 3Cl2+6KOH═5KCl+KClO3+3H2O |