题目内容
1.2-丁烯是一种重要的有机化工原料.回答下列问题:(1)己知2一丁烯有顺、反两种同分异构体,可表示为顺-C4H8、顺-C4H8.一定条件下,它们分别发生加成反应的热化学方程式为:
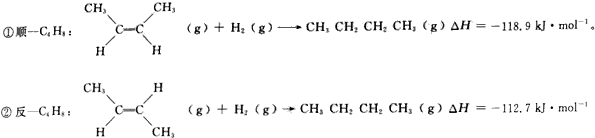
相同条件下,两种气体之间存在如下转化:

该反应的反应热为:△H=-6.2kJ/mol.下列叙述中能表明该反应已达到平衡状态的是a (填序号)
a.顺-C4H8的含量保待不变
b.混合气体的平均摩尔质量保持不变
c.混合气体中碳的质量分数保持不变
达到平衡后,若要进一步提高体系中反C4H8的含量,可采取的措施是降温.
(2)2-丁烯与氢气反应时,一般用镍作催化剂,镍具有优良的物理和化学特性,是许多领域尤其是高科技产业的重要原料.
①羰基法提纯粗镍涉及的两步反应依次为:
Ⅰ.Ni(S)+4CO(g)$\stackrel{50℃}{?}$Ni(CO)4(g)△H<0;
Ⅱ.Ni(CO)4(g)$\stackrel{230℃}{?}$Ni(S)+4CO(g),
则图1中能反映出羰基法提纯粗镍过程中能量变化的是a.

②在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如图2所示.Ni(CO)4在0~10min的平均反应速率为0.05mol/(L•min).
③若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时b(填序号)
a.平衡常数K增大 b.CO的浓度减小 c.v正[Ni(CO)4]增大
④设计简单实验方案用羰基法提纯粗镍,将粗镍粉末装入玻璃管一端,抽真空后充入CO并封管,控制温度在50℃,一段时间后在玻璃管的另一端加热至230℃,即可在该端获得纯净的镍.
分析 (1)将方程式①-②得目标方程式,焓变进行相应的改变;
可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
若要进一步提高体系中反C4H8的含量可以采用降低温度的方法;
(2)①反应I放出热量,说明反应物总能量大于生成物总能量;反应II应该吸收热量,则反应物总能量小于生成物总能量;
②随反应进行,粗镍减少的质量即为参加反应①消耗的镍的质量,粗镍的纯度98.5%,1-10min内粗镍质量减少100g-41g=59g;镍的质量=59g×98.5%=58.115g在0~10min,生成Ni的物质的量=$\frac{(100-41)g×98.5%}{59g/mol}$=0.985mol,v=$\frac{\frac{n}{V}}{△t}$;
③若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,正逆反应速率都减小,平衡逆向移动;
④50℃Ni反应生成Ni(CO)4,230℃时Ni(CO)4分解生成Ni,通过改变温度设计实验.
解答 解:(1)将方程式①-②得目标方程式,△H=(-119.8kJ/mol)-(-112.7kJ/mol)=-62kJ/mol;
a.顺-C4H8的含量保待不变时,正逆反应速率相等,反应达到平衡状态,故正确;
b.无论反应是否达到平衡状态,混合气体的平均摩尔质量始终保持不变,不能据此判断平衡状态,故错误;
c.无论反应是否达到平衡状态,混合气体中碳的质量分数始终保持不变,不能据此判断平衡状态,故错误;
故选a;
该反应的正反应是放热反应,若要进一步提高体系中反C4H8的含量可以采用降低温度的方法;
故答案为:-6.2kJ•mol-1;a;降低温度;
(2)①反应I放出热量,说明反应物总能量大于生成物总能量;反应II应该吸收热量,则反应物总能量小于生成物总能量,只有a符合,故选a;
②随反应进行,粗镍减少的质量即为参加反应①消耗的镍的质量,粗镍的纯度98.5%,1-10min内粗镍质量减少100g-41g=59g;镍的质量=59g×98.5%=58.115g在0~10min,生成Ni的物质的量=$\frac{(100-41)g×98.5%}{59g/mol}$=0.985mol,故在0~10min,v[Ni(CO)4]=$\frac{\frac{0.985mol}{2L}}{10min}$=0.985mol/(2L×10min)=0.05mol/(L•min);
故答案为:0.05mol/(L•min);
③若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,正逆反应速率都减小,平衡逆向移动,平衡常数减小、CO浓度减小、v正[Ni(CO)4]减小,故选b;
④50℃Ni反应生成Ni(CO)4,230℃时Ni(CO)4分解生成Ni,通过改变温度设计实验,实验设计方案为控制温度在50℃,一段时间后在玻璃管的另一端加热至230℃,即可在该端获得纯净的镍,
故答案为:控制温度在50℃,一段时间后在玻璃管的另一端加热至230℃,即可在该端获得纯净的镍.
点评 本题考查化学平衡计算、化学平衡移动影响因素、化学平衡状态判断等知识点,侧重考查学生分析判断、计算及知识灵活运用能力,难点是实验方案设计,要根据两个方程式差异性设计实验,题目难度中等.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案| A. | 研究物质的性质时,常用到观察、实验、分类、比较、模型、假设等方法 | |
| B. | 研究物质性质的一般程序的第二步是观察物质的外观 | |
| C. | 可以用分类的方法预测物质的性质 | |
| D. | 观察是一种有计划、有目的地用感官考察研究对象的方法 |
| 组别 | c(一元酸) | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | c(HX)=0.1mol•L-1 | 0.1 | pH=x |
| 乙 | c(HY)=0.1mol•L-1 | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol•L-1 | 0.1 | pH=9 |
(2)部分实验反应过程中的pH变化曲线如图:

①表示乙组实验的pH变化曲线是图1(填“图1”或“图2”)
②以上两图中表示溶液恰好完全反应的点是BE.
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,所得溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L
②c(OH-)=1.0×10-3 mol•L-1的氨水c L
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.则a、b、c、d的大小关系是b>a=d>c.
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图3中表示醋酸溶液中pH变化曲线的是B(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1 <m2(填“<”、“=”、“>”)
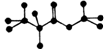
| A. | 该物质在酸性条件下水解生成乙酸 | |
| B. | 该物质含有双键,能跟氢气发生加成反应 | |
| C. | 该物质属于酯类 | |
| D. | 分子式为C3H8O2 |
| A. | 冰毒、黄连素 | B. | 海洛因、冰毒 | C. | 大麻、摇头丸 | D. | 黄曲霉素、尼古丁 |
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
| A. | 甲中反应的平衡常数小于乙 | |
| B. | 该温度下,该反应的平衡常数K为400 | |
| C. | SO2的平衡转化率:α1>α2=α3 | |
| D. | 容器中SO3的物质的量浓度:丙=丁<甲 |
 在$\frac{C{u}_{2}O}{ZnO}$做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH(g)的物质的量(n)与时间(t)及温度的关系如图所示:
在$\frac{C{u}_{2}O}{ZnO}$做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH(g)的物质的量(n)与时间(t)及温度的关系如图所示: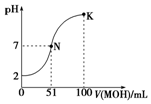 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题: