题目内容
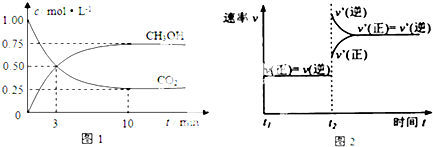
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )


| A、若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) |
| B、200℃时,反应从开始到刚好达平衡的平均速率v(B)=0.02 mol?L-1?min-1 |
| C、图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0 |
| D、200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数大于0.5 |
考点:化学平衡的计算
专题:化学平衡专题
分析:A.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移;
B.由图Ⅰ可知,200℃时平衡时,B的物质的量变化量为0.4mol-0.2mol,根据v=
计算v(B);
C.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,据此判断反应热效应;
D.200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,根据图Ⅰ中A、B、C的物质的量变化量之比等于化学计量数之比确定x、y、z,据此判断增大压强平衡移动方向.
B.由图Ⅰ可知,200℃时平衡时,B的物质的量变化量为0.4mol-0.2mol,根据v=
| ||
| △t |
C.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,据此判断反应热效应;
D.200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,根据图Ⅰ中A、B、C的物质的量变化量之比等于化学计量数之比确定x、y、z,据此判断增大压强平衡移动方向.
解答:
解:A.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移动,故v(正)=v(逆),故A错误;
B.由图Ⅰ可知,200℃时5min达到平衡,平衡时B的物质的量变化量为0.4mol-0.2mol=0.2mol,故v(B)=
=0.02 mol?L-1?min-1,故B正确;
C.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即△H>0,故C错误;
D.由图Ⅰ可知,200℃时平衡时,A、B、C的物质的量变化量分别为0.4mol、0.2mol、0.2mol,物质的量之比等于化学计量数之比,故x:y;z=0.4mol:0.2mol:0.2mol=2:1:1,平衡时A 的体积分数为
=0.5,200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,A的增大,故达到平衡时,A 的体积分数小于0.5,故D错误;
故选B.
B.由图Ⅰ可知,200℃时5min达到平衡,平衡时B的物质的量变化量为0.4mol-0.2mol=0.2mol,故v(B)=
| ||
| 5min |
C.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即△H>0,故C错误;
D.由图Ⅰ可知,200℃时平衡时,A、B、C的物质的量变化量分别为0.4mol、0.2mol、0.2mol,物质的量之比等于化学计量数之比,故x:y;z=0.4mol:0.2mol:0.2mol=2:1:1,平衡时A 的体积分数为
| 0.4mol |
| 0.4mol+0.2mol+0.2m0l |
故选B.
点评:本题考查化学平衡图象、反应速率计算、影响化学平衡的因素、化学平衡有关计算等,难度中等,答题时注意化学原理知识的灵活运用.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列说法正确的是( )
| A、只含有一种元素的物质一定是单质 |
| B、胶体与溶液的本质区别在于是否有丁达尔现象 |
| C、一定温度、压强下,气体体积由其物质的量的多少决定 |
| D、向盛有沸水的烧杯中滴加FeCl3溶液并长时间煮沸,制备Fe(OH)3胶体 |
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )


| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、实验仪器D可以起到防止溶液倒吸的作用 |
| C、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D、若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液不变浑浊 |
下列溶液中各微粒的浓度关系正确的是( )
| A、醋酸钠中加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
| C、1.0 mol?L -1Na2CO3溶液:c(OH-)=2c(HCO3-)+c(H+)+c(H2CO3) |
| D、物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):(NH4)2SO4>NH4HSO4>NH4Cl |
反应A(g)+3B(g)?2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
| A、υ(D)=0.4 mol/(L?s) |
| B、υ(C)=0.6mol/(L?s) |
| C、υ(B)=0.5mol/(L?s) |
| D、υ(A)=0.15 mol/(L?s) |
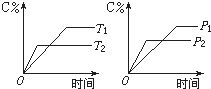 可逆反应mA(s)+nB(g)?pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( )
可逆反应mA(s)+nB(g)?pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( )| A、到达平衡后,若使用催化剂,C的质量分数增大 |
| B、平衡后,若升高温度,平衡则向逆反应方向移动 |
| C、平衡后,增大A的量,有利于平衡向正反应方向移动 |
| D、化学方程式中一定n>p+q |
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )

| A、该电池能够在高温下工作 | ||
| B、放电过程中,H+从正极区向负极区迁移 | ||
| C、电池的负极反应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | ||
D、在电池反应中,每消耗1 mol 氧气,理论上能生成标准状况下CO2气体
|
30℃时,在某硫酸铜溶液中加入27.5g CuSO4或加入50.0g CuSO4?5H2O,恢复到30℃时,都刚好成为饱和溶液,则30℃时CuSO4的溶解度是( )
| A、4.5 g |
| B、22.5 g |
| C、25 g |
| D、32 g |