题目内容
8.某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如下面如图1所示.根据图中数据,请填写下列空白: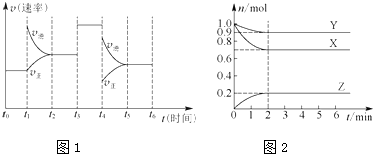
(1)该反应的平衡常数表达式为K=$\frac{{c}^{2}(Z)}{{c}^{3}(X)•c(Y)}$.
(2)反应开始至2min,用气体Z表示的反应速率为0.05 mol•L-1•min-1.
(3)反应达到平衡时:①压强是开始时的0.9倍;
②、若此时将容器的体积缩小为原来的$\frac{1}{2}$,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应反应热△H<0(填“<”或“>”或“=”).
(4)若上述反应在2min后的t1~t6内反应速率与反应时间图象如图2,在每一时刻均改变一个影响反应速率的因素,则BE
A.在t1时增大了压强
B.在t3时加入了催化剂
C.在t4时降低了温度
D.t2~t3时反应物的转化率最高
E.t0~t1时反应物的转化率最高
F.t3~t4时反应物的转化率最高
G.t5~t6时反应物的转化率最高.
分析 (1)根据物质的量变化曲线,可知X、Y物质的量减小,为反应物;反应物没有完全反应,所以该反应为可逆反应;Z物质的量增加,为生成物,再根据其物质的量变化量之比等于其计量数之比,可写出化学方程式,然后书写平衡常数表达式;
(2)根据2min内Z物质的量变化量和容器体积,可知道浓度变化量,通过计算可知用气体Z表示的反应速率;
(3)①气体的压强之比等于气体的物质的量之比,可求出开始时气体的总物质的量和平衡后气体总物质的量,得到答案;
②体积缩小到原来的0.5倍,则压强变为原来的2倍,平衡向着气体体积缩小的方向移动,根据反应方程式可知,平衡向右移动;
(4)根据图象,t1时增大了生成物的浓度,平衡逆向移动;t3时加入了催化剂,平衡不移动;t4时应为减小压强,平衡逆向移动,由此分析解答.
解答 解:(1)由图象可知X、Y为反应物,Z为生成物,X、Y、Z的化学计量数之比等于它们的物质的量变化之比为0.3:0.1:0.2=3:1:2,所以方程式为3X+Y?2Z,所以平衡常数表达式为:K=$\frac{{c}^{2}(Z)}{{c}^{3}(X)•c(Y)}$,故答案为:K=$\frac{{c}^{2}(Z)}{{c}^{3}(X)•c(Y)}$;
(2)v(Z)=$\frac{0.2mol}{2L×2min}$=0.05 mol•L-1•min-1.故答案为:0.05 mol•L-1•min-1;
(3)①根据图象中可知,开始时气体总物质的量为:2mol;平衡后气体总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,$\frac{{P}_{平衡}}{{P}_{起始}}$=$\frac{{n}_{平衡}}{{n}_{起始}}$=$\frac{1.8mol}{2mol}$═0.9,
故答案为:0.9;
②根据方程式,减小体积,平衡正向移动,容器内温度将升高,故该反应为放热反应.故答案为:<;
(4)根据图象,t1时增大了生成物的浓度,平衡逆向移动;t3时加入了催化剂,平衡不移动;t4时应为减小压强,平衡逆向移动,t0~t1时反应物的转化率最高
,故BE选项正确,故答案为:BE.
点评 该题通过图象中物质的物质的量的变化,来考查化学平衡的移动、化学反应速率计算,综合考查学生对知识的综合应用能力.

| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 铝箔在空气中受热可以融化,由于氧化膜的存在,融化的铝并不滴落 |
| A. | 纳米材料是指一种称为“纳米”的新物质制成的材料 | |
| B. | 复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性质超过了单一材料 | |
| C. | 淀粉和纤维素通式都是(C6H10O5)n,都是天然高分子化合物 | |
| D. | 合成纤维的主要原料是石油、天然气、煤等 |
| 加入的物质 | 结论 | |
| A | 50mL 1mol/L H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.5mol CaO | 溶液中$\frac{c(O{H}^{-})}{c(HC{O}_{3}^{-})}$增大 |
| C | 50mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| D | 0.1mol NaHSO4固体 | 反应完全后,溶液pH减小,c (Na+)不变 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1molSO2与0.5molO2反应生成的SO3分子数为NA | |
| B. | 标准状况下,11.2LHF中含有的共价键为0.5NA | |
| C. | 1L 0.5mol/LCH3COOH溶液中含有的H+数大于0.5NA | |
| D. | 一定量的铁与1mol氯气恰好完全反应,转移电子数为2NA |
| A. | 3O3$\frac{\underline{\;放电\;}}{\;}$2O3 | B. | 2KClO3 $\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | ||
| C. | Cl2+2NaOH═NaCl+NaClO+H2O | D. | CO+CuO $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+CO2 |